1. Bahan yang digunakan sebagai elektrode pada sel aki (accu) adalah …
a. Pt dan C
b. Zn dan C
c. Pb dan PbO2
d. Zn dan Cu
e. Cu dan PbO2
Jawaban : C
Pembahasan :
Aki merupakan sel yang banyak kita jumpai karena banyak digunakan pada sepeda motor maupun mobil. Aki termasuk sel sekunder, karena selain menghasilkan arus listrik, aki juga dapat diisi arus listrik kembali.
Secara sederhana Sesuai prinsip pada sel Volta, aki merupakan sel yang terdiri dari elektrode Pb sebagai anode dan PbO2 sebagai katode dengan elektrolit H2SO4
2. Diketahui :
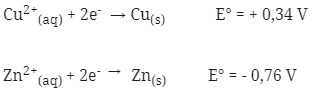
Bila kedua logam tersebut dipasangkan untuk membentuk sel volta, maka pernyataan berikut yang tidak benar adalah …
a. Elektrode Zn teroksidasi dan Elektrode Cu tereduksi
b. Elektrode Zn Sebagai Anode dan Cu sebagai Katode
c. Potensial sel yang dihasilkan adalah 1,10 volt
d. Notasi selnya : Zn(s)|Zn2+(aq)||Cu2+(aq)|Cu E°sel = 1,10 V
e. Dalam sistem sel volta tersebut elektron bergerak dari Cu menuju Zn
Jawaban : E
Pembahasan :
- Logam yang memiliki E° lebih kecil selalu merupakan Anode (mengalami oksidasi), berarti yang termasuk anode adalah Zn (E° = – 0,76 V) karena memiliki E° yang lebih kecil dari pada Cu (E° = + 0,34 V).
- Karena Zn sebagai Anode maka mengalami oksidasi sedangkan Cu sebagai Katode mengalami reduksi
- Notasi sel volta : Anode|ion||ion|katode
Maka :
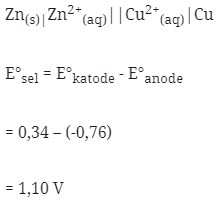
- Dalam sel volta elektron bergerak dari Anode ke Katode berarti dari Zn Menuju Cu
Kesimpulannya, pernyataan yang tidak benar adalah jawaban E
3. Logam yang tidak diperoleh dengan proses elektrolisis adalah …
a. Natrium
b. Aluminium
c. Magnesium
d. Kalsium
e. Merkuri
Jawaban : E
Pembahasan :
Logam-logam Natrium, Aluminium, Magnesium, dan Kalsium diperoleh dengan proses elektrolisis, sebab logam-logam ini tergolong reduktor kuat. Logam Merkuri (Raksa) adalah logam yang berwujud cair pada suhu kamar, tidak diendapkan di Katode.
Logam ini diperoleh dengan Pemanggangan HgS atau pemanasan HgO.
Reaksinya :
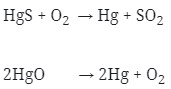
4. Pada elektrolisis larutan CuSO4 dengan elektrode Pt, dialirkan arus listrik 2 Ampere selama 965 detik (Ar Cu=63,5) maka banyaknya logam tembaga yang dihasilkan … mg
a. 317,5
b. 635,0
c. 952,5
d. 1.270
e. 1.905
Jawaban : B
Pembahasan :
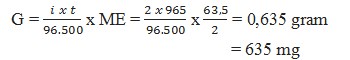
5. Berapakah massa logam perak yang diendapkan jika arus listrik sebesar 5 Ampere dialirkan kedalam larutan AgNO3 selama 2 jam ? (Ar Ag = 108)
a. 24,90 gram
b. 29,40 gram
c. 40,29 gram
d. 42,09 gram
e. 49,20 gram
Jawaban : C
Pembahasan :
Dik : i = 5 A
t = 2 jam = 7.200 detik
n = muatan kation Ag+ yakni +1
Dit : Massa endapan Ag ?
Jawaban :
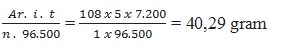
6. Berikut adalah beberapa elektrode yang dapat dikombinasikan menjadi pasangan sel Volta:
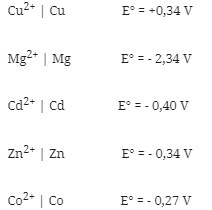
Dari kelima elektrode tersebut yang tidak mungkin menjadi katode adalah elektrode …
a. Cu
b. Cd
c. Co
d. Mg
e. Zn
Jawaban : D
Pembahasan :
Logam yang memiliki E° lebih kecil selalu merupakan Anode. Dari kelima elektrode tersebut yang memiliki E° paling kecil adalah Mg sehingga Mg tidak mungkin menjadi katode karena Mg sebagai Anode.
7. Logam yang dapat mencegah korosi pada bumper mobil adalah …
a. Kromium
b. Timbal
c. Timah
d. Magnesium
e. Nikel
Jawaban : A
Pembahasan :
Untuk mencegah korosi pada bumper mobil, bumper mobil tersebut dilapisi oleh kromium.
Kromium dapat melindungi bumper mobil dari korosi. Kromium juga memberi kesan yang mengkilap pada bumper mobil. Proses pelapisan ini dinamakan Cromium Plating (pelapisan dengan kromium.
8. Pada elektrolisis leburan Al2O3 ( Ar O = 16, Al = 27 ) diperoleh 0,225 gram Al. Jumlah Arus Listrik yang diperlukan adalah …
a. 2.221,9 Coulomb
b. 2.804,0 Coulomb
c. 2.025,9 Coulomb
d. 2.412,5 Coulomb
e. 2.685,0 Coulomb
Jawaban : D
Pembahasan :
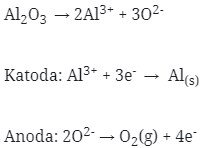
Mol Al = gram / ar = 0.225 / 27 = 0,00833 mol
Mol e = 12 / 4 x mol Al = 3 x 0,00833 = 0,025 mol e = 0.025 F
Q = 0,025 x 96.500 = 2.412,5 Coulomb
9. Oksidasi 1 mol ion sianida (CN–) menjadi ion sianat (CNO–) memerlukan muatan listrik sebanyak ….. Faraday
a. 1
b. 2
c. 3
d. 4
e. 5
Jawaban : B
Pembahasan :
![]()
Dari reaksi diatas terlihat bahwa jika 1 mol ion sianida (CN–) dioksidasi menjadi ion sianat (CNO–) maka akan memerlukan sebanyak 2 mol elektron atau sebanyak 2 Faraday.
10. Reaksi :
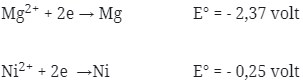
Potensial yang dihasilkan oleh reaksi Mg + NiCl2 → MgCl2 + Ni adalah …
a. -2,12 volt
b. +2,12 volt
c. +1,06 volt
d. -2,62 volt
e. +0,80 volt
Jawaban : B
Pembahasan :
Perhatikan E° nya ! logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi). Sudah pasti bahwa Mg adalah anode (mengalami oksidasi) dan Ni adalah Katode (mengalami reduksi).
Pada soal reaksi tidak berbentuk ion, berarti NiCl2 dan MgCl2 dipecah lagi sehingga menghasilkan ion.
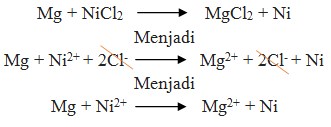
E°sel = E°katode – E°anode
= – 0,25 – (- 2,37 )
= + 2,12 volt
11. Bila diketahui potensial elektrode standar dari :
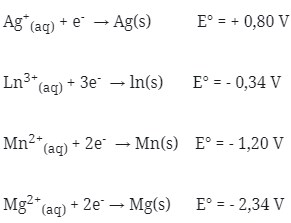
Pasangan sel volta yang akan menghasilkan potensial sel sebesar 0,86 V adalah …
a. ln|ln3+||3Ag+|3Ag
b. Mg|Mg2+||Mn2+|Mn
c. Mn|Mn2+||2Ag+|Ag
d. 2ln|2ln3+||3Mn2+|3Mn
e. 3Mn|3Mn2+||2ln3+|2ln
Jawaban : E
Pembahasan :
Dicari satu persatu potensial sel dari pilihan jawaban
(a) E°sel = E°katode – E°anode
= +0,80 – (- 0,34 ) = 1,14 V
(b) E°sel = E°katode – E°anode
= -1,20 – (-2,34) = 1,14 V
(c) E°sel = E°katode – E°anode
= + 0,80 – (-1,20) = 2 V
(d) E°sel = E°katode – E°anode
= – 1,20 – (- 0,34) = – 0,86 V
(e) E°sel = E°katode – E°anode
= – 0,34 – (- 1,20) = 0,86 V
Jadi, jawaban yang benar adalah E
12. Diketahui :
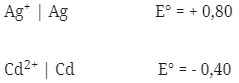
Potensial sel yang dihasilkan dari pasangan elektrode Cd dengan Ag adalah …
a. 0,40 V
b. 0,44 V
c. 0,76 V
d. 0,80 V
e. 1,20 V
Jawaban : E
Pembahasan :
Logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi) berarti yang sebagai anode Cd dan sebagai katode Ag.
Notasi Selnya :
Cd|Cd2+||Ag+|Ag
E°sel = E°katode – E°anode
= + 0,80 – (-0,40)
= 1,20 V
13. Berikut ini adalah faktor-faktor yang dapat mempercepat terjadinya korosi, kecuali …
a. Banyaknya uap air disekitar logam
b. Bersinggungan langsung dengan udara
c. Banyaknya oksigen disekitar logam
d. Banyak terdapat uap asam disekitar logam
e. Disekitar logam tidak ada oksigen
Jawaban : E
Pembahasan :
Faktor-faktor yang dapat mempercepat korosi :
- Oksigen
Oksigen berperan dalam proses korosi. Hal ini dapat dibuktikan dengan berkaratnya besi jika terjadi oksidasi pada logam. - Air dan kelembapan udara
Semakin besi tersebut terkena air, semakin cepat pula korosinya. Kelembapan udara juga sangat mempengaruhi dalam korosi. - Zat elektrolit
Zat-zat elektrolit terutama hujan asam dan garam dapat mempengaruhi korosi. - Permukaan logam
Apabila didekatkan (dilengketkan) dengan besi, maka dapat mempercepat korosi. Dan permukaan yang kasar relatif lebih mempercepat korosi.
- Sel elektrokimia
Sel elektrokimia dapat terbentuk ketika dua atau lebih logam potensial elektrodanya berbeda bersentuhan satu sama lain.
Kesimpulanya jawabannya adalah E karena jika disekitar logam tidak ada oksigen maka tidak akan menyebabkan korosi.
14. Berapa faraday yang diperlukan untuk mereduksi 60 gram ion kalsium menjadi logam kalsium …. (Ar = Ca = 40)
a. 1,0
b. 1,5
c. 2,0
d. 3,0
e. 4,0
Jawaban : D
Pembahasan :
Rumus yang digunakan adalah :
W = e × F
60 = (Ar ÷ biloks Ca) × F
60 = (40 ÷ 2) × F
F = 60 ÷ 20
F = 3
15. Bila kedalam larutan NiSO4 dialirkan listrik sebesar 0.1 F, dan Ar Ni = 59, maka dikatode akan didapat logam Ni seberat …
a. 59,00 g
b. 29,50 g
c. 14,75 g
d. 5,90 g
e. 2,95 g
Jawaban : E
Pembahasan :
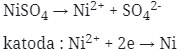
w = (Ar × F) ÷ muatan Ni
= (59 × 0,1) ÷ 2
= 2,95
16. Aki mempunyai elektrode Pb dan PbO2. Selama aki itu bekerja, akan terjadi perubahan-perubahan …
a. Pb dan PbO2 berubah menjadi Pb3O4
b. Pb dan PbO2 berubah menjadi PbSO4
c. Pb menjadi PbO2 dan PbO2 menjadi PbSO4
d. Pb menjadi PbO dan PbO2 menjadi Pb3O4
e. Pb menjadi PbSO4 dan PbO2 tetap
Pembahasan :
Aki merupakan salah satu aplikasi dari sel volta. sel volta adalah sel elektrokimia dimana energi kimia (reaksi redoks) diubah menjadi energi liistrik. Sel aki terdiri dari Pb sebagai anode dan PbO2 sebagai katode dan terdapat larutan elektrolit H2SO4.
Sehingga pada anode terjadi terjadi reaksi oksidasi dan pada katode terjadi reaksi reduksi. Sehingga pada saat sel menghasilkan arus listrik, reaksi yang terjadi adalah :
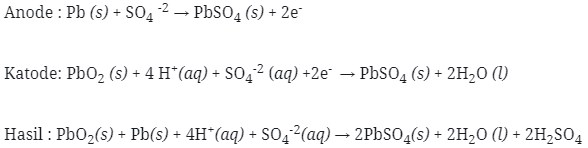
Sehingga jawaban yang benar adalah pilihan B, dikarenakan Pb mengalami oksidasi menjadi PbO2 jika dilihat dari perubahan biloks Pb yang mempunyai biloks 0 berubah menjadi +2
didalam PbO dan PbO2 mengalami reduksi menjadi PbSO4 jika dilihat dari perubahan biloks, biloks Pb didalam PbO2 adalah +4 berubah menjadi +2 didala PbSO4 .
Jawaban : B
17. Suatu sel volta tersusun dari elektrode-elektrode timah dan aluminium
Sn 2+ + 2e– → Sn Eo = -0,14 volt
Al3+ + 3e → Al Eo = -1,66 volt
Pernyataan dibawah ini yang tidak benar adalah …
a. Aluminium merupakan anode
b. Potensial sel adalah 1,52 volt
c. Elektron mengalir dari aluminium ke timah
d. Diagram sel adalah Sn | Sn 2+ || Al 3+ | Al
e. Reaksi sel adalah 2Al + 3Sn+2 → 2Al3+ + 3Sn
Pembahasan :
Sel Volta merupakan sel elktrokimia dimana energi kimia (reaksi redoks) diubah menjadi energi listrik. Sehingga pada anode terjadi terjadi reaksi oksidasi dan pada katode terjadi reaksi reduksi.
Pada sel volta anode merupakan elektrode negatif sehingga bilangan Eo lebih kecil daripada katode yang merupakan elektrode positif sehingga mempunyai Eo lebih besar.
Pernyataan yang benar adalah :
Timah merupakan katode, sedangkan Aluminum merupakan Anode.
Potensial sel adalah
Eo sel = Eo reduksi- Eo Oksidasi
Eo sel = -0,14 – (-1,66)
= 1,52
Reaksi sel adalah 2Al + 3Sn → 3Sn + Al+3
Anode : 2Al → Al+3 + 3e
Katode : 3Sn+2 + 2e → 3Sn
Jawaban : D
18. Diketahui :
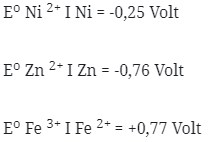
Pada keadaan standar, pernyataan yang benar adalah …
a. Zn merupakan reduktor lebih baik daripada Ni
b. Zn 2+ dapat mengoksidasi Fe 2+ menjadi Fe 3+
c. Ni dapat mereduksi Fe 3+ menjadi Fe2+
d. Ni dapat mereduksi Zn 2+ menjadi Zn
Pembahasan :
Eo atau singkatan dari potensial reduksi adalah potensial listik yang ditibulkan apabila suatu ion logam mengalami reduksi (menangkap elektron) menjadi logamnya.
Makin mudah suatu ion logam mengalami reduksi, makin besar Eo yang ditimbulkan. Berikut adalah hal yang penting diperhatikan dalam deret volta :
- Makin kekanan letak suatu logam dalam deret volta, sifat reduktornya makin lemah (makin sukar mengalami oksidasi)
- Suatu logam dalam Deret Volta mampu mereduksi ion-ion dikanannya tetapi tidak mampu mereduksi ion-ion dikirinya
Sehingga dalam deret volta, Posisi dari kiri kekanan adalah Zn, Fe, Ni. Dalam hal ini Zn mampu mereduksi Fe 3+ menjadi Fe 2+, dan mereduksi Ni 2+ menjadi Ni.
Fe mampu mereduksi Ni 2+ menjadi Ni, namun tidak mampu mereduksi Zn. Ni tidak dapat mereduksi Zn dan Fe dikarenakan posisi Ni didalam deret volta paling kanan sehingga tidak dapat mereduksi ion-ion dikanannya.
Jawaban : A
20. Diketahui data Eo Zn = – 0,76 volt dapat dikatakan bahan dalam keadaan standar …
a. reaksi Zn2+ + 2e– → Zn selalu tidak spontan
b. ion Zn 2+ adalah oksidator kuat
c. ion H+ lebih mudah tereduksi daripada ion Zn 2+
d. Zn mempunyai kecenderungan lebih besar untuk larut sebagai ion Zn2+
e. H adalah reduktor yang lebih kuat daripada Zn
Pembahasan :
Nilai Potensial Zn = -0,76 volt adalah nilai potensial reduksi Ion Zn 2+ + 2e– → Zn. Berdasarkan letak logam Zn didalam deret volta, logam Zn terletak sebelum atau disebelah kiri H.
Logam yang berada disebelah kiri H akan sukar tereduksi, serta memiliki nilai potensial negatif. Sehingga pernyataan yang benar adalah ion H+ lebih mudah tereduksi daripada ion Zn 2+ .
Jawaban : C
20. Logam yang dapat mencegah korosi pipa besi yang ditanam didalam tanah adalah …
a. Tembaga
b. Timbal
c. Timah
d. Magnesium
e. Nikel
Pembahasan :
Magnesium adalah logam yang jauh lebih aktif berarti lebih mudah daripada besi. Jika logam magnesium dikontakkan dengan besi, maka magnesium itu akan berkarat tetapi besi tidak.
Cara ini digunakan untuk melindungi pipa baja yang ditanam dalam tanah atau badan kapal laut. secara periodik, batang magnesium harus diganti.
Jawaban : D
21. Pada proses elektrolisi larutan NaOH dengan elektrode Pt, reaksi kimia yang terjadi pada katode adalah …
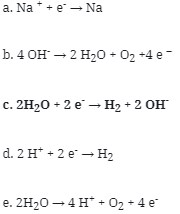
Pembahasan :
Pada proses elektrolisis katode merupakan tempat terjadinya reduksi, sedangkan anode merupakan tempat terjadinya oksidasi. Elektrode yang digunakan dalam sel elektrolisi dapat berupa elektrode inert dan elektrode non inert.
elektrode Pt merupakan elektrode inert yang tidak bereaksi, hanya meneydiakan permukaannya sebagai tempat berlangsungnya reaksi. Dalam elektrolisi larutan, jika kation yang digunakan adalah logam alkali, alakali tanah, dan logam Al maka yang direduksi dikatode adalah pelarutnya yaitu air.
Hal ini terjadi karena kompetisi kation dengan molekul air dalam menangkap elektron. Sehingga io-ion logam yang memiliki Eo lebih kecil dari Eo air yaitu -0,83 volt tidak direduksi dari larutan sebab air lebih mudah menangkap elektron dibandingkan ion logam. Dikarenakan logam Na berada digolongan IA maka reaksi dikatode adalah
2H2O + 2 e– → H2 + 2 OH–
Jawaban : C
22. Untuk memperoleh 33,6 liter gas Cl2 pada STP, jumlah gas yang digunakan pada elektrolisis larutan NaCl adalah …
a. 0,75 faraday
b. 1 Faraday
c. 1,50 Faraday
d. 2 Faraday
e. 3 Faraday
Pembahasan :
Diketahui : V gas Cl2 = 33,6 liter
elektrolisi larutan NaCl
A : 2 Cl– → Cl2 + 2e –
K : 2H2O + 2 e– → H2 + 2 OH–
Sehingga dalam keadaan STP :
mol = v / 22.4
mol = 33.6 / 22.4 = 1,5 mol
2 Cl– → Cl2 + 2e –
Karena pada pembentukan gas Cl2 melepaskan 2 elektron maka :
mol = F / Valensi
1,5 mol = F / 2
Maka F = 3 Faraday
Jawaban : E
23. Sejumlah arus digunakan untuk mengendapkan 18 gram perak dari larutan AgNO3, dan mengendapkan 5 gram logam M dari larutan M(SO4)2. Jika Ar perak 108 maka Ar Logam M adalah …
a. 30
b. 36
c. 45
d. 48
e. 60
Jawaban : E
Pembahasan :
Ag+ + e – → Ag
jumlah mol elektron yang diterima adalah 1 mol
M +2 + 2e – → 2M
Jumlah mole elektron yang diterima adalah 2
Maka :
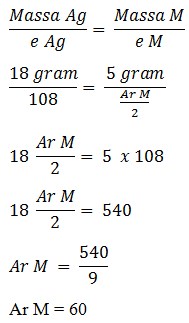
24. Dalam sel elektrolisis terdapat 200 ml larutan CuSO4 2 M. Untuk mengendapkan semua tembaga dengan kuat arus 10 A maka diperlukan waktu ….
a. 965 detik
b. 3860 detik
c. 96500 detik
d. 9650 detik
e. 19300 detik
Pembahasan :
Diketahui : V = 0,2 L, i = 10 A, Larutan CuSO4 2 M
mol = M x V
mol = 2 x 0,2
mol = 0,4 mol
1 mol e- = 1 F
0,4 mol e- = 0,4 F
Maka :
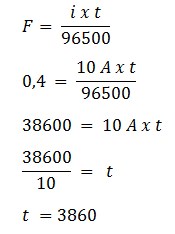
Jawaban : B
25. Pada persamaan reaksi Fe +H2SO4 → FeSO4 +H2.
Ar Fe adalah 56 maka berat ekivalen Fe adalah …
a. 112
b. 56
c. 28
d. 14
e. 224
Pembahasan :
Reaksi yang terjadi adalah :
Fe → Fe+2 +2e–
Berat ekivalen = Ar Fe/ jumlah elektron yang diterima atau dilepaskan
Berat ekivalen = 56 / 2 = 28
Jawaban : C
26. Pernyataan yang tepat tentang pembuatan logam alkali secara elektrolisis adalah …
a. dibuat dari elektrolisis larutan garam kloridanya
b. digunakan katode karbon dan anode dari besi
c. ion logam alkali yang terbentuk berupa zat padat di anode
d. reduksi ion logam alkali terjadi dianode
e. logam alkali yang terbentuk berupa zat padat di anode
Pembahasan :
Pada pembuatan logam alkali melalui elektrolisis digunakan lelehan atau leburan dari senyaa yang mengandung logam alkali dengan menggunakan elektroda karbon dan anode dari besi.
Sebab jika yang digunakan adalah larutan, maka yang direduksi adalah air dikatode. Pada elktrolisis reaksi reduksi terjadi dikatode dan oksidasi terjadi di anode
Jawaban : B
27. Pada elektrolisis larutan AgNO3 dengan elektrode karbon digunakan muatan listrik 0,05 F. Banyaknya perak Ar Ag = 108 yang dendapkan pada katode adalah … gram
a. 2,7
b. 5,4
c. 8,1
d. 10,8
e. 54,0
Pembahasan :
1 mol e = 1 F
0,05 mol = 0,05 F
Reaksi yang terjadi ;
Ag+ + e– → Ag
0,05 mol ~ 0,05 mol ~ 0,05 mol
mol = gr/mr
0,05 = gr/108 = 5,4 gram
Jawaban : B
28. Diketahui :

Dua setengah sel yang beda potensialnya terbesar adalah. . .
a. Zn/Zn2+, Ag+/Ag
b. Mg/Mg2+ , Fe2+/Fe
c. Fe/Fe2+, Ag+/Ag
d. Zn/Zn2+, Fe2+/ Fe
e. Mg/Mg2+, Ag+/Ag
Pembahasan :
Eo reduksi = – Eo Oksidasi
Beda potensial terbesar adalah pada :
Mg → Mg +2 + 2e– Eo = 2,34 Volt
Ag + + e– → Ag Eo =0,80 volt
Jawaban : E
29. Pada elektrolisis larutan tembaga (II) sulfat dengan elektrode tembaga, di anode terjadi reaksi…
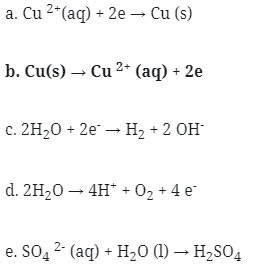
Pembahasan :
Pada sel elektrolisis di anode terjadi reaksi oksidasi. Jika menggunakan elektrode selain Pt, Au dan C maka elektroda itu sendiri bereaksi dianode. Sehingga di anode terjadi reaksi : Cu(s) → Cu 2+ (aq) + 2e
Jawaban : B
30. Pada elektrolisis cairan MgCl2, pada katode dan anode berturut dibebaskan …
a. H2 dan Cl2
b. H2 dan O2
c. Mg dan Cl2
d. Mg dan H2
e. Mg dan O2
Jawaban : C
Pembahasan :
Pada elektrolisis cairan MgCl2 dengan elektrode grafit
MgCl2(l) → Mg2+(l) + 2Cl–(l)
Pada elektrolisis lelehan senyaa ion dengan elektrode inert, maka kation direduksi dikatode sedangkan anion dioksidasi dianode.
katode : Mg 2+ (l) + 2e– → Mg (s)
Anode : 2Cl–(l) → Cl2(g) + 2e-
Sehingga pada katode dihasilkan Mg dan dianode Cl2
31. Data potensial reduksi:
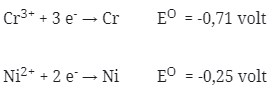
Pada suatu sel volta berlangsung reaksi
2 Cr + 3 NiCl2 → 3 Ni + 2 CrCl3
Potensial sel (EO) reaksi tersebut adalah…Volt
a. +0,96
b. +0,67
c. +0,46
d. -0,46
e. -0,96
Jawaban: C
Pembahasan:

EO = Ereduksi – Eoksidasi
= ENi – ECr
= -0,25 – (-0,71)
= +0,46 volt
32. Korosi dari logam besi menghasilkan karat. Rumus kimia karat besi adalah…
a. FeO
b. Fe3O2
c. Fe2O3
d. Fe3O2.xH2O
e. Fe2O3.xH2O
Jawaban : E
Pembahasan:
Ion Fe2+ bergabung dengan ion OH– membentuk Fe(OH)2 . Pada akhirnya Fe(OH)2 yang terbentuk bergabung dengan gas oksigen dan air, membentuk karat besi dengan rumus kimia Fe2O3.xH2O.
33. Pada elektrolisis cairan natrium klorida, pada katode dan anode berturut-turut dibebaskan …
a. H2 dan Cl2
b. H2 dan O2
c. Na dan Cl2
d. Na dan H2
e. Na dan O2
Jawaban: C
Pembahasan:
Elektrolisis “cairan” sama dengan lelehan, artinya air maupun elektrode tidak ikut tereduksi atau teroksidasi. Natrium klorida (NaCl) memiliki kation Na+ dan anion Cl–. Nah, terjadi reaksi:
- Katode: Na+ + e– → Na
- Anode: 2Cl– → Cl2 + 2e–
34. Jika diketahui:
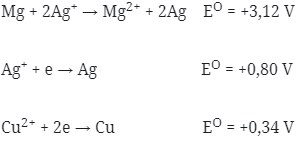
Maka potensial standar bagi reaksi:
Mg + Cu2+→ Mg2+ + Cu adalah…
a. +3,08V
b. +2,66V
c. +2,40V
d. +2,22V
e. +2,12V
Jawaban: B
Pembahasan:
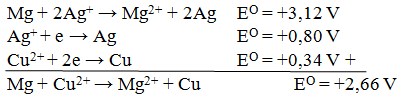
35. Pada elektrolisis lelehan MgCl2 dengan elektrode grafik di katode akan dihasilkan?
a. Gas klorin
b. Gas Hidrogen
c. Larutan Mg(OH)2
d. Logam Mg
e. Gas oksigen
Jawaban: D
Pembahasan:
MgCl2 → Mg2+ + Cl2– . Dimana syarat katoda harus positif, anoda negatif. sehingga Yang dihasilkan ialah logam Mg
36. Reaksi yang terjadi pada anode dari sel kering (sel leclanche) adalah…
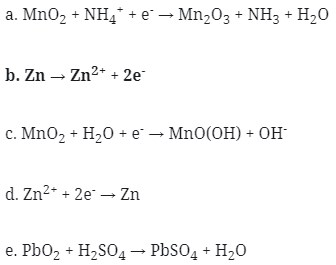
Jawaban: B
Pembahasan:
Sel leclanche terdiri atas suatu silinder zink yang berisi pasta dari campuran batu kawi (MnO2), salmiak (NH4Cl), karbon (C), dan sedikit air (jadi sel ini tidak 100% kering).
Zink berfungsi sebagai anode, sedangkan sebagai katode digunakan electrode inert,yaitu grafit, yang dicelupkan ditengah-tengah pasta. Pasta itu sendiri berfungsi sebagai oksidator.
Reaksi yang terjadi:
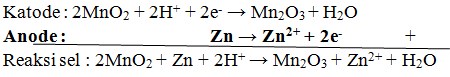
37. Arus listrik yang sama dialirkan melalui larutan CuSO4 dan AgNO3. Jika pada proses elektrolisis tersebut terbentuk 6,35 gram Cu, maka massa Ag yang terbentuk adalah… (Ar Cu = 63,5 dan Ag = 108)
a. 3,175 gram
b. 6,35 gram
c. 10,8 gram
d. 21,6 gram
e. 31,75 gram
Jawaban: D
Pembahasan:
Cu2+ + 2e– → Cu
Ag+ + e– → Ag
Jika CuSO4 merupakan larutan 1 dan AgNO3 merupakan larutan 2, maka,
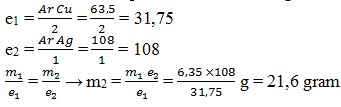
38. Diketahui :
Cu2+ + 2e– → Cu EO = +0,34 V
Ag+ + e– → Ag E0 = +0,80 V
Maka:
Cu + 2Ag+ → Cu2+ + 2Ag
EO sel = …V
a. 0,06
b. 0,46
c. 0,50
d. 1,14
e. 1,26
Jawaban : B
Pembahasan:
EO sel = EOkatoda – EOanoda
EO sel = EO Ag – EO Cu
EO sel = +0,80 – (+0,34)
EO sel =0,46 V
39. Perhatikan persamaan reaksi berikut!
Ag+ + e– → Ag E0 = +0,79 V
Mg2+ + 2e → Mg EO = -2,34 V
Harga EOsel dari reaksi tersebut adalah…
a. +3,13 V
b. +1,55 V
c. -3,13 V
d. -1,55 V
e. -3,89 V
Jawaban: A
Pembahasan:
EOsel = EOreduksi – EOoksidasi
EOsel = EOAg – EOMg
EOsel = +0,79 –(-2,34)
EOsel = +3,13 Volt
40. Jika elektrolisis larutan HCl dengan elektrod C dan kuat arus yang digunakan adalah 0,1 Faraday, maka massa H2 yang terbentuk adalah . . .
a. 0,1 gram
b. 0,2 gram
c. 0,3 gram
d. 0,4 gram
e. 0,5 gram
Jawaban: A
Pembahasan:
HCl → H+ + Cl–
H2 adalah hasil reduksi ion H+ pada katode yaitu:
2H+ + 2e– → H2
m = ar/e × F
m = 2/2 × 0,1 gram = 0,1 gram
massa H2 yang terbentuk adalah 0,1 gram
41. Logam yang digunakan untuk mencegah korosi dengan cara galvanisasi adalah . . .
a. Zn
b. Cu
c. Ag
d. Pb
e. Sn
Jawaban: A
Pembahasan:
Galvanisasi adalah pelapisan dengan zink. Zink dapat melindungi besi dari korosi sekalipun lapisannya tidak utuh. Hal itu terjadi karena suatu mekanisme yang disebut perlindungan katode.
Oleh karena potensial reduksi besi lebih positif dari pada zink, maka besi yang kontak dengan zink akan membentuk sel elektrokimia dengan besi sebagai katode. Dengan demikian, besi terlindungi dan zink yang mengalami oksidasi.
42. Jika larutan Na2SO4 dielektrolisis dengan elektroda karbon, reaksi yang terjadi pada anode adalah…
a. 2H2O + 2e– → H2 + 2OH–
b. 2H2O → 4H+ + O2+ 4e–
c. Na →Na+ + e–
d. 2H+ + 2e– → H2
e. SO42- → SO2 + O2
Jawaban : B
Pembahasan:
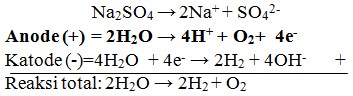
43. Arus yang dialirkan kedalam larutan CuSO4 dengan kuat arus 10 ampere, maka massa tembaga yang dapat dibebaskan adalah… (Ar Cu = 63,5)
a. 0,3175 gram
b. 1,08 gram
c. 2,16 gram
d. 3,175 gram
e. 6,35 gram
Jawaban : D
Pembahasan:
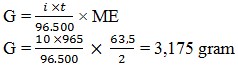
44. Diketahui:
Cu2+ + 2e– → Cu EO = 0,34 Volt
Mg2+ + 2e– → Mg EO = -2,34 Volt
Potensial reaksi berikut adalah…
Cu + Mg2+ → Cu2+ + Mg
a. +3,12 Volt
b. -3,12 Volt
c. +2,68 Volt
d. -2,68 Volt
e. -0,13 Volt
Jawaban : D
Pembahasan:
EOsel = EOreduksi – EOoksidasi
EOsel = EOCu – EOMg
EOsel = (0,34 – (-2,34)) volt
EOsel = 2,68 Volt
45. Diketahui dua buah sel volta yang dinyatakan dengan notasi sebagai berikut:
Mg | Mg2+ || Zn2+ | Zn EO = +1,61 Volt
Zn | Zn2+ || Fe2+ | Fe EO = +0,32 Volt
Berdasarkan sel volta diatas, maka EOSel untuk sel volta berikut adalah…
Mg | Mg2+ || Fe2+ | Fe
a. +1,93 volt
b. -1,93 volt
c. +1,28 volt
d. -1,28 volt
e. +0,32 volt
Jawaban : A
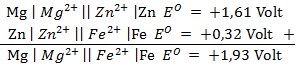


Tidak ada komentar:
Posting Komentar