1. Sifat koligatif larutan adalah sifat yang bergantung pada ….
a. Jenis zat terlarut
b. Jenis zat pelaut
c. Jumlah zat pelarut
d. Jumlah zat terlarut
e. Konsentrasi larutan
JAWABAN : D
PEMBAHASAN
Sifat koligatif larutan adalah sifat-sifat yang hanya tergantung pada Jumlah (kuantitas) partikel zat terlarut dalam larutan dan tidak bergantung pada jenis atau identitas partikel zat terlarut, tidak peduli dalam bentuk otom, ion, ataupun molekul. Sifat koligatif merupakan sifat yang hanya memandang “kuantitas” bukan “kualitas”.
(Nana Sutrisna, Kimia Untuk kelas XII, Bandung : Grafindo Media Pratama, 2013, Hal 30)
2. Salah satu yang akan di sebebkan oleh keberadaan zat terlarut dalam pelarut adalah ….
a. Tekanan uap jenuh lebih tinggi daripada tekanan uap jenuh pelarut
b. Titik beku larutan lebih tinggi daripada titik beku pelarut
c. Tekanan osmosis larutan lebih rendah dari tekanan osmosis pelarut
d. Titik didih larutan lebih tinggi daripada titik didih pelarut
e. Titik didih pelarut lebih tinggi dari pelarutnya
JAWABAN : D
PEMBAHASAN
Keberadaan zat terlarut dalam pelarut dapat mengakibatkan terjadinya kenaikan titik didih larutan,karena terjadinya penurunan tekanan uap larutan oleh keberadaan zat terlarut tersebut. Sehingga dibutuhkan kenaikan temperatur untuk menaikkan tekanan uap larutan sehingga sama dengan tekanan eksternal.
(Nana Sutrisna, Kimia Untuk kelas XII, Bandung : Grafindo Media Pratama, 2013, Hal 29)
3. Larutan fruktosa dengan konsentrasi 1,476 M mempunyai massa jenis 1,1 g/ml. Berapa kemolala larutan adalah …. (Mr fruktosa = 180)
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
e. 1,90 mol/kg
JAWABAN : C
PEMBAHASAN
Basis perhitungan 1 L larutan fruktosa
Kemolalan laerutan fruktosa, m = n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa = 1,476 mol
– menghitung massa air, w air = w larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/ml x 1000 ml
= 1100 g
Massa fruktosa = n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
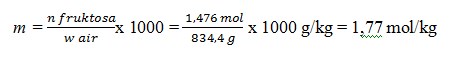
4. Fraksi mol larutan methanol CH3OH dalam air adalah 0,50. Kosentrasi methanol dalam larutan ini dinyataan dalam persen berat methanol adalah …. Ar C = 12, O = 16, H =1
a. 64 %
b. 54%
c. 63%
d. 62%
e. 60%
JAWABAN : A
PEMBAHASAN :
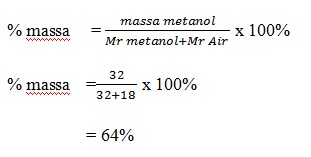
5. Jika didalam suatu larutan yang dibuat dengan melarutkan 4,5 gram glukosa (C6H12O6) dalam 100 gram air,kemolalanya adalah …. (Ar C = 12, H =1, O = 16)
a. 0,25 molal
b. 0,4 molal
c. 0,3 molal
d. 0,5 molal
e. 0,43 molal
JAWABAN : A
PEMBAHASAN
Mr C6H12O6 = 180
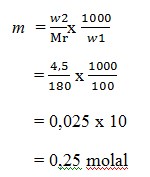
6. jika suatu larutan mengandung 24 gram MgSO4 dilarutkan dalam 500 gram air.. molalitasnya adalah ….(Mr MgSO4 = 120)
a. 0,5 molal
b. 0,7 molal
c. 0,6 molal
d. 0,4 molal
e. 0,9 molal
JAWABAN : D
PEMBAHASAN
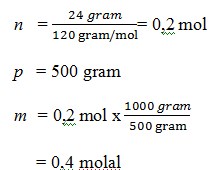
7. Didalam suatu larutan yang telah dibuat dari 5 gram kristal NaOH yang dilarutkan ke dalam air hingga volumenya 500 mL, konsentrasinya adalah …. (Mr NaOH = 40)
a. 0,1 mol/L
b. 0,5 mol/L
c. 0,25 mol/L
d. 0,7 mol/L
e. 0,35 mol/L
JAWABAN : C
PEMBAHASAN
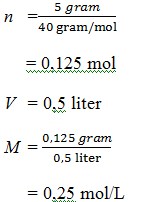
8. Jika didalam zat terlarut dan zat pelarut ada 200 gram air dan dilarutkan 30 gram asam cuka (CH3COOH) fraksi molnya zat pelarut adalah (Ar C = 12, H= 1, O = 16) ….
a. 0,943
b. 0,957
c. 0,987
d. 0,945
e. 0,975
JAWABAN : B
PEMBAHASAN
Mr CH3COOH = 60
M r H2O = 18

(Tine Maria Kuswati, dkk, Kimia 3 SMA Kelas XII, Jakarta : PT Bumi Aksara, 2007, hal 9)
9. Jika didalam suatu larutan yang dibuat dengan melarutkan 5,5 gram glukosa (C6H12O6) dalam 200 gram air,kemolalanya adalah …. (Ar C = 12, H =1, O = 16)
a. 0,25 molal
b. 0,14 molal
c. 0,35 molal
d. 0,05 molal
e. 0,15 molal
JAWABAN : E
PEMBAHASAN
Mr C6H12O6 = 180
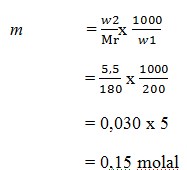
10. Jika didalam suatu larutan yang dibuat dengan melarutkan 5,5 gram glukosa (C6H12O6) dalam 200 gram air,kemolalanya adalah …. (Ar C = 12, H =1, O = 16)
a. 0,25 molal
b. 0,14 molal
c. 0,35 molal
d. 0,05 molal
e. 0,15 molal
JAWABAN : E
PEMBAHASAN
Mr C6H12O6 = 180
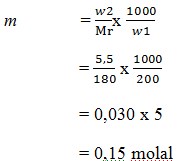
11. Sebanyak 11,7 gram NaCl (Mr = 58,5) dilarutkan dalam 500 gram air. Titik didih larutan adalah …. (Kb air = 0,52oC/m)
a. 100,420C
b. 98,90C
c. 50,890C
d. 1000,540C
e. 65,780C
JAWABAN : A
PEMBAHASAN
Reaksi ionisasi : NaCl(aq) → Na + + Cl –(aq)
n = banyaknya ion =1 + 1 = 2
jika derajat ionisasi tidak diketahui, α dianggap 1.
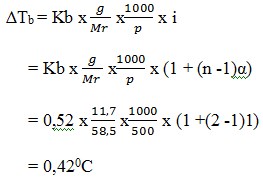
Titik didih NaCl = 1000C + 0.420C = 100,420C
12. Berapa banyaknya Al2(SO4)3 (Mr = 342) yang harus dilarutkan dalam 250 gram air, agar larutan tersebut membeku pada suhu -3 adalah …. (Kf air = 1,860C/m)
a. 30,5 gram
b. 45,60 gram
c. 27,6 gram
d. 25,5 gram
e. 25,4 gram
JAWABAN : C
PEMBAHASAN
Reaksi ionisasi (n) = 2 + 3 = 5
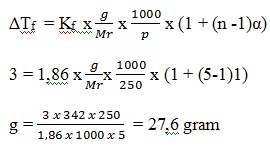
Jadi massa Al2(SO4)3 yang harus dilarutkan adalah 27,6 gram.
(Sumarjo, jalan pintas pintar kimia, Jakarta : Andi Yogyakarta, 2010, Hal 220)
13. Larutan elektrolit biner 5,85 gram dalam 500 gram membeku pada suhu -1,240C jika Kf air = 1,860C/m. Mr yang dibutuhkan adalah ….
a. 30,5
b. 29,5
c. 30,1
d. 35,1
e. 34,1
JAWABAN : D
PEMBAHASAN
Elektrolit biner → n = 2
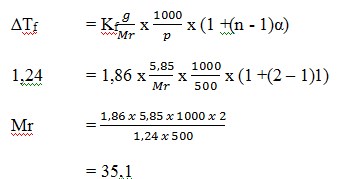
(Sumarjo, jalan pintas pintar kimia, Jakarta : Andi Yogyakarta, 2010, Hal 220)
14. 10,4 gram BaCl2 yang dilarutkan dalam 1000 gram air ternyata mempunyai kenaikan titik didih 1,4 kali kenaikan titik didih 3 gram urea (CO(NH2)2) yang dilarutkan dalam 500 gram air. Faktor Van't Hoff (i) BaCl2 dalam larutan adalah …. (Mr BaCl = 208, urea = 60 )
a. 2,7
b. 2,8
c. 2,9
d. 3,0
e. 3,5
JAWABAN : B
PEMBAHASAN
∆Tb BaCl2 = 1,4 ∆Tb (CO(NH2)2)
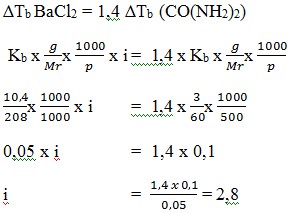
(Sumarjo, jalan pintas pintar kimia, Jakarta : Andi Yogyakarta, 2010, Hal 223-224)
15. Pada suhu 270C, glukosa C6H12O6 (Mr = 180) sebanyak 8,5 gram dilarutkan dalam air sampai volumenya 500 ml R= 0,082 L atm mol-1 K-1. Tekanan osmosis larutan yang terjadi sebesar ….
a. 2,3546 atm
b. 2,3344 atm
c. 2,3123 atm
d. 2,3024 atm
e. 2,3124 atm
JAWABAN : E
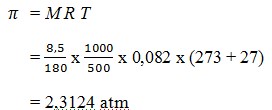
(Mustafal Bakri, Seri Pendalaman Materi Untuk SMA, Jakarta : Erlangga, 2008, Hal 108)
16. Semakin tinggi temperatur maka ….
a. Semakin besar tekanan uap zat cair
b. Sama dengan tekanan uap zat cair
c. Semakin rendah tekana uap zat cair
d. Tekanan uap tidak berpengaruh
e. Tidak ada tekanan uapnya
JAWABAN : A
PEMBAHASAN
Suatu zat cair pada setiap temperatur membunyai tekanan uap yang berbeda. Semain tinggi temperatur, semakin besar tekanan uap zat cair itu.
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara. 2005. Hal 10)
17. Pada pelarut di masukkan zat terlarut yang sukar menguap maka tekanan uap pelarut tersebut akan turun, yang disebabkan oleh ….
a. Terdapat gaya tolak-menolak antar molekul
b. Terdapat gaya tarik-menarik antar molekul
c. Terdapat molekul yang tidak berpasangan
d. Terdapat banyak molekul yang sama
e. Terdapat molekul yang besar ukuran partikelnya
JAWABAN : B
PEMBAHASAN
Jika kedalam pelarut dimasukkan zat terlarut yang sukar menguap maka tekanan uap pelarut tersebut akan turun disebabkan karena antara molekul zat terlarut dan molekul perlarut timbul gaya tarik-menarik.
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara. 2005. Hal 11)
18. Tekanan uap murni pada temperatur 50 adalah 92.50 mmHg. Ketika di dalam air dimasukkan sejumlah gula (sukrosa), maka tekanan uapnya turun menjadi 92.20 mmHg. Maka penurunan tekanan uap yang terjadi adalah ….
a. 0,80 mmHg
b. 0,92 mmHg
c. 0,30 mmHg
d. 0,20 mmHg
e. 0,50 mmHg
JAWABAN : C
PEMBAHASAN
Diketahui:
= Mula-mula tekanan uap air sebelum penambahan gula 92,50 mmHg
P = Setelah penambahan gula tekanan turun menjadi 92,20 mmHg
Maka Penurunan tekanan uap = (92.50 – 92.20) mmHg = 0.30 mmHg
19. Hubungan tekanan uap dengan fraksi mol adalah ….
a. Berbanding lurus
b. Berbanding terbalik
c. Tidak berhubungan
d. Bila tekanan uap tetap fraksi mol semakin besar
e. Tidak sabil
JAWABAN : A
PEMBAHASAN
Pada tahun 1887, F.M. Raoult (1830-1901) menyatakan bahwa penurunan tekanan uap relatif (Po – P) atau ΔP berbanding lurus dengan fraksi mol zat terlarut.
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara.2005.hal 11)
20. dengan melarutkan 5 gram glukosa dalam 100 gram air, maka kemolalan larutan yang terbentuk (Ar C=12, H=1, O=16) adalah ….
a. 0,25 molal
b. 0,35 molal
c. 0,28 molal
d. 0,75 molal
e. 0,30 molal
JAWABAN : C
PEMBAHASAN
Mr glukosa= 180
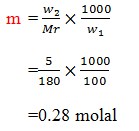
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara. 2005. Hal 7)
21. larutan NaOH membunyai konsentrasi 2 m (molal). Maka fraksi air adalah …. ( Ar O = 16, H = 1)
a. 0,04
b. 0,96
c. 0,77
d. 0,55
e. 0,66
JAWABAN : B
PEMBAHASAN
Mr H2O = 18
Mr NaOH = 40
2 molal NaOH artinya = Setiap 1000 gram air terdapat 80 gr NaOH
mol NaOH = 80 gr/ 40 gr/mol = 2 mol NaOH
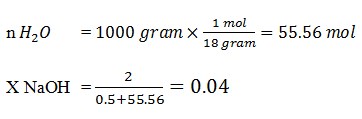
X = 1 – 0.04 = 0.96
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara. 2005. Hal 9)
22. Tekanan uap pada temperatur 30 adalah 55.30 mmHg. Maka penurunan tekanan uap, jika kedalam 108 gram air dilarutkan 36 gram glukosa Jika (Ar C=12, H=1, O=16) adalah ….
a. 66 mmHg
b. 33 mmHg
c. 45 mmHg
d. 48 mmHg
e. 56 mmHg
JAWABAN : A
PEMBAHASAN
Karena penurunan tekanan sebanding dengan fraksi mol zat terlarut maka dicari terlebih dahulu fraksi mol zat terlarut.
Mr C6H12O6 = 180
Mr H2O = 18
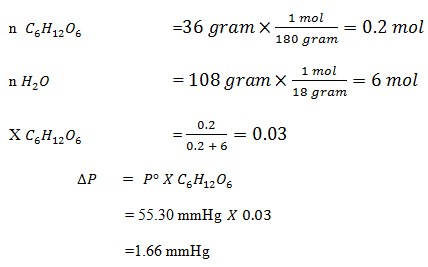
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara. 2005. Hal 13)
23. Suatu larutan yang mengandung 22% massa urea , CO(NH2)2, Jika tekanan uap jenuh air pada temperatur adalah 92.50 mmHg dan massa larutan 200 gram. Maka tekanan uap jenuh larutan tersebut adalah ….
a. 1 mmHg
b. 1 mmHg
c. 1 mmHg
d. 1 mmHg
e. 55 mmHg
JAWABAN : C
Tekanan uap larutan sebanding dengan fraksi mol pelarut, oleh karena itu dicari terlebih dahulu fraksi mol pelarut.
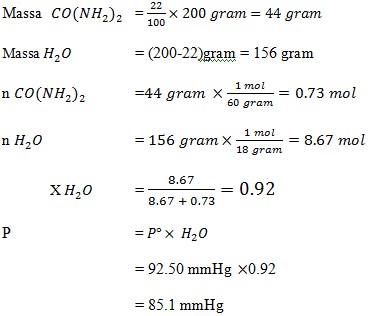
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara. 2005. Hal 13)
24. Air murni akan mendidih pada saat proses pemanasan berlangsung, kecuali ….
a. Pada saat tekanan 1 atm
b. Pada saat temperatur 100oC
c. Pada saat tekanan sama dengan 760 mmHg
d. Pada saat tekanan uap jenuh zat cair itu sama dengan tekanan udara disekitar
e. Pada saat tekanan sama dengan 610 mmHg
JAWABAN : E
PEMBAHASAN
Suatu zat cair akan mendidih jika tekanan uap jenuh zat cair itu sama dengan tekanan udara disekitarnya. Apabila air murni di panaskan pada tekanan 1 atm (760mmHg) maka air akan mendidih pada temperatur 100oC , karena pada temperatur itu tekanan uap air sama dengan tekanan udara di sekitarnya.
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara. 2005. Hal 13)
25. Air murni di larutkan dengan sukrosa, maka tekanannya pada saat pemanasan berlangsung adalah ….
a. Tekanan uap air akan turun
b. Tekanan uap air akan naik
c. Larutan tersebut akan mendidih pada saat tekanan kurang dari 1 atm
d. Larutan tersebut tidak akan mendidih pada saat temperatur sampai di atas 100oC
e. Larutan akan cepat mendidih pada saat temperatur belum mencapai 100oC
JAWABAN : A
PEMBAHASAN
Apabila pada temperatur 100oC dilarutkan sukrosa maka tekanan uap air akan turun. Semakin banyak sukrosa yanag dilarutkan, semakin besar penurunan tekanan uapnya,
Sehingga pada temperatur 100oC larutan sukrosa belum mendidih sebab telanannya kurang dari 760 mmHg. Larutan ini memerlukan temperatur yang lebih tinggi lagi agar tekanan uap jenuhnya sama dengan tekanan udara di sekitarnya.
(Tine Maria Kuswati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara.2005.hal 14)
26. Kenaikan titik didih larutan 5 molal sukrosa adalah …. (Kb air = 0,51oC)
a. 51oC
b. 53oC
c. 55oC
d. 57oC
e. 59oC
JAWABAN : C
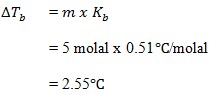
27. 60 gram glukosa (C6H12O6) dalam 500 gram benzena, jika diketahui titik didih benzena 78.5 dan kb benzena 2,52oC/molal (Ar C=12, H=1, O=16), maka titik didih larutan tersebut adalah ….
a. 79.3oC
b. 79.29oC
c. 79.19oC
d. 79.27oC
e. 79.22oC
JAWABAN : B
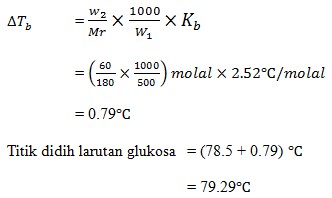
(Erlangga, Drs. Unggul Sudarmo M.pd, 2013, Hal 15)
28. Suatu zat nonelektrolit yang massanya 8 gram dilarutkan dalam 200 gram air. Larutan itu mendidih pada temperatur 100,8oC. Maka Mr zat tersebut adalah ….(Kb air = 0,51oC)
a. 255
b. 355
c. 155
d. 155
e. 125
JAWABAN : A
Mula-mula dicari kenaikan titik didih larutan
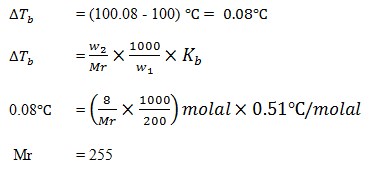
29. Tekanan uap air murni pada temperatur 27 adalah 26.74 mmHg. Jika kedalam 100 gram air dilarutkan 36 gram glukosa ( Maka tekanan uap larutan tersebut adalah ….
a. 89 mmHg
b. 89 mmHg
c. 82 mmHg
d. 82 mmHg
e. 82 mmHg
JAWABAN : C

30. 8 gram alumunium sulfat dalam 200 gram air, jika derajat ionisasi adalah 0.9 ( (Al = 27, S = 32, O = 16). Maka titik didih larutan tersebut adalah ….
a. 1028oC
b. 1027oC
c. 1026oC
d. 1025oC
e. 1024oC
JAWABAN : B
Mula-mula dibuat reaksi ionisasinya untuk menentukan harga v.
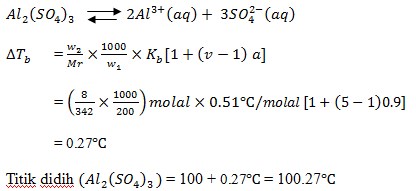
(Tine Maria Ku swati dkk, sains KIMIA 3 SMA/MA. Bumi Akasara. 2005. Hal 27)
31. Sebanyak 1,8 gram zat nonelektrolit dilarutkan ke dalam 200 gram air. Jika penurunan titik beku larutan = 0,93oC (Kf air = 1,86oC m-1), massa molekul relatif zat tersebut adalah ….
a. 18 gram/mol
b. 19 gram/mol
c. 20 gram/mol
d. 21 gram/mol
e. 22 gram/mol
(KIMIA 3, Nana Sutresna, Grafindo Media Pratama, 2013, Hal 14)
JAWABAN: A
PEMBAHASAN
Diketahui:
- Massa = 1,8 gram
- Massa air (pelarut) = 200 gram
- ΔTf= 0,93oC
- Kf air = 1,86oC m-1
Ditanya : Mr ?

32. Sebanyak 4 gram NaOH (Mr = 40) dilarutkan dalam 750 gram air. Jika derajat ionisasi larutan NaOH 75% dan Kf air 1,86oC m-1 maka penurunan titik beku larutan NaOH adalah ….
a. -0,43oC
b. -0,23oC
c. 0,23oC
d. 0,43oC
e. 0,73oC
(JALAN PINTAS PINTAR KIMIA, Sumarjono, ANDI Yogyakarta, 2010, Hal 114)
JAWABAN : D
PEMBAHASAN
diketahui:
- Massa NaOH (terlarut) = 4 gram
- Mr NaOH = 40
- Massa air (pelarut) = 750 gram
- Derajat ionisasi = 75% (0,75)
- Kf air = 1,86oC m-1
Ditanya: ΔTf?
Pertama-tama kita mencari faktor van’t Hoff (i)
NaOH Na+ + OH–
n = jumlah ion yang dihasilkan yaitu 2
i = 1 + (n -1) α
i = 1 + (2-1) 0,75
i = 1,75
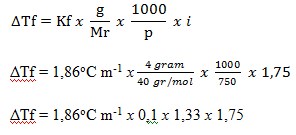
ΔTf = 0,43oC
33. Senyawa X (Mr = 100) yang tidak dapat menghantarkan listrik dilarutkan dalam 250 gram benzen, ternyata memberikan penurunan titik beku (ΔTf) sebesar 1,024o Jika diketahui harga Kf benzen = 5,12oC m-1 maka berat senyawa yang dilarutkan adalah ….
a. 0,5 gram
b. 2,5 gram
c. 5,0 gram
d. 7,5 gram
e. 10 gram
JAWABAN : C
PEMBAHASAN
Diketahui:
- Mr X = 100
- Massa benzen = 250 gram
- ΔTf = 1,024
- Kf benzen = 5,12oC m-1
Ditanya : Massa X?

34. Data percobaan penurunan titik beku:
| Larutan | Konsentrasi (molal) | Titik beku ( ) |
| Urea | 0,10 | -0,1860 |
| 0,01 | -0,0186 | |
| Garam dapur | 0,10 | -0,3720 |
| 0,01 | -0,0372 | |
| Gula | 0,10 | -0,1860 |
| 0,01 | -0,0186 |
Berdasarkan data percobaan di atas, maka besarnya penurunan titik beku larutan ditentukan oleh ….
a. Jenis zat terlarut
b. Jumlah partikel zat terlarut
c. Jenis larutan
d. Jenis pelarut
e. Perbedaan titik beku pelarut
JAWABAN : B
PEMBAHASAN
Penurunan titik beku larutan merupakan sifat koligatif, seperti halnya kenaikan titik didih. Penurunan titik beku tidak dipengaruhi (ditentukan) oleh jenis (macam) zat yang terlarut, tetapi ditentukan oleh seberapa banyak jumlah zat yang terlarut.
Berdasarkan data di atas dapat dilihat bahwa semakin besar konsentrasi zat terlarut dalam suatu larutan, maka semakin rendah titik beku larutan tersebut dan semakin rendah konsentrasi zat terlarut dalam suatu larutan, maka titik beku larutan akan semakin tinggi.
Hal ini disebabkan oleh larutan yang mempunyai konsentrasi lebih tinggi mempunyai jumlah partikel yang lebih banyak sehingga lebih sukar untuk membuat tekanan padatannya. Sehingga titik beku larutan tersebut lebih rendah atau peristiwa saat larutan tersebut mulai membeku lebih lama.
35. Untuk menurunkan titik beku 500 gram air menjadi -0,062oC (Kf air = 1,86oC/molal) maka jumlah urea (CO(NH2)2) (Ar C = 12, O = 16, N = 14, H = 1) yang harus dilarutkan adalah ….
a. 0,2 gram
b. 0,5 gram
c. 1 gram
d. 2 gram
e. 4 gram
JAWABAN : C
PEMBAHASAN
Diketahui:
- Massa pelarut = 500 gram
- Tf = – 0,062oC
- Mr (CO(NH2)2) = 60
Mr = 12 + 16 + (2 x 14) + (4 x 1)
Mr = 28 + 28 + 4 = 60
- Kf air = 1,86oC/molal
Ditanya : massa terlarut ?
Pertama-tama kita menentukan ΔTf
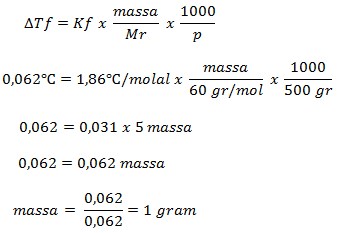
36. Glukosa (C6H12O6) yang massanya 45 gram dilarutkan dalam 250 gram air (Kf air = 1,86oC/molal). Jika diketahui Ar C = 12, H = 1, dan O = 16 maka titik beku larutan tersebut adalah ….
a. 1,86oC
b. 0,46oC
c. 0,23oC
d. -0,46oC
e. -1,86oC
(Sains KIMIA 3, Tine Maria Kuswati, dkk, PT Bumi Aksara, 2007, Hal 35)
JAWABAN : E
PEMBAHASAN
Diketahui:
- Massa terlarut = 45 gram
- Massa pelarut = 250 gram
- Kf air = 1,86oC/molal
- Mr C6H12O6 = 180
Mr C6H12O6 = (6 x 12) + (12 x 1) + (6 x 16) = 180
Ditanya : ΔTf ?
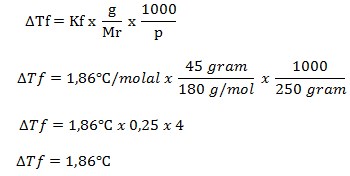
Kemudian, ditentukan Tf nya
Tf = 0 – 1,86oC = -1,86oC
Jadi, titik beku larutannya adalah -1,86oC
37. Sukrosa (Mr = 342) sebanyak 6,84 gram dilarutkan dalam air sampai volumenya 100 ml. Tekanan osmosis larutan yang terbentuk jika diukur pada suhu 27oC adalah ….
a. 0,092 atm
b. 0,984 atm
c. 4,92 atm
d. 6,15 atm
e. 9,84 atm
JAWABAN : C
PEMBAHASAN
Diketahui:
- Mr = 342
- Massa = 6,48 gram
- Volume = 100 ml = 0,1 L
- T = 27oC + 273 = 300 K
- R = 0,082 L atm/mol K-1
Ditanya : ?
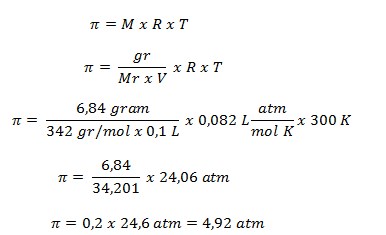
38. Dalam 400 mL larutan terdapat 2,4 gram zat nonelektrolit. Jika pada suhu 27oC, tekanan osmosis larutan 2,46 atm, massa molekul relatif (Mr) zat tersebut adalah ….
a. 46
b. 58,5
c. 80
d. 98
e. 60
JAWABAN : E
PEMBAHASAN

39. Pada suhu 27oC, sukrosa ( C12H22O11) Mr = 342 gram/mol. Sebanyak 17,1 gram dilarutkan dalam air sampai mencapai volume 500 mL. jika diketahui R = 0,082 L atm/mol K-1, tekanan osmosis larutan yang terjadi adalah ….
a. 0,39 atm
b. 2,46 atm
c. 3,90 atm
d. 4,80 atm
e. 30,00 atm
JAWABAN : B
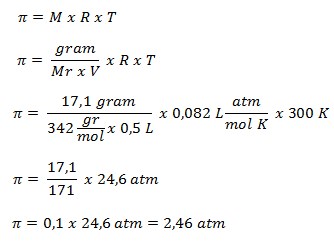
40. Larutan urea sebanyak 500 mL mempunyai tekanan osmosis sebesar 2,46 atm pada suhu 27o Jika Mr urea adalah 60 dan R = 0,082 L atm/mol K-1. Maka konsentrasi larutan urea tersebut adalah ….
a. 0,01 M
b. 0,02 M
c. 0,05 M
d. 0,10 M
e. 0,20 M
(KIMIA 3, J.M.C. Johari, MSc. Dan Ir. M. Rachmawati, Mphil, Esis, 2008, Hal 29)
JAWABAN : D
PEMBAHASAN
Diketahui:
- V = 500 mL = 0,5 L
- = 2,46 atm
- T = 27oC + 273 = 300 K
- R = 0,082 L atm/mol K-1
- Mr = 60
Ditanya : Konsentrasi (M) ?

41. Dalam 250 mL suatu larutan terdapat 24 gram zat X yang bersifat nonelektrolit. Jika pada temperatur 27oC, tekanan osmosis larutan 32,8 atm, massa molekul relatif (Mr) zat X adalah …. (R = 0,082 L atm/mol K-1)
a. 36
b. 48
c. 72
d. 96
e. 144
(KIMIA 3, Nana Sutresna, Grafindo Media Pratama, 2013, Hal 27)
JAWABAN : C
Diketahui:
- V = 250 mL = 0,25 L
- Massa = 24 gram
- T = 27oC + 273 = 300 K
- R = 0,082 L atm/mol K-1
- = 32,8 atm
Ditanya : Massa molekul relatif (Mr) ?

42. Larutan H2SO4 1 molal terionisasi 90%. Kf air = 1,86oC/molal. Maka titik beku larutan tersebut adalah ….
a. -5,208oC
b. -4,208oC
c. -3,208oC
d. 4,208oC
e. 5,208oC
(KIMIA 3, Nana Sutresna, Grafindo Media Pratama, 2013, Hal 25)
JAWABAN : A
PEMBAHASAN
Diketahui:
- H2SO4 = 1 molal
- Kf air = 1,86oC/molal
- α = 90% = 0,9
ditanya : ΔTf ?
H2SO4 -----> 2H+ + SO42-
n = 3
i = 1 + (n – 1) α
i = 1 + (3 – 1) 0,9
i = 1 + 1,8
i = 2,8
ΔTf = Kf x m x i
ΔTf = 1,86oC/molal x 1 molal x 2,8
ΔTf = 5,208oC
Tf = 0 – 5,208oC = -5,208oC
Jadi titik beku larutan tersebut adalah -5,208oC
43. tekanan osmosis larutan NaCl 0,1 M pada suhu 27oC adalah 4,8 atm. Maka persentase derajat ionisasi larutan tersebut adalah ….
a. 0,85
b. 0,95
c. 0,90
d. 0,80
e. 0,75
JAWABAN : B
PEMBAHASAN
Diketahui:
- = 4,8 atm
- T = 27oC + 273 = 300 K
- M = 0,1 M
- R = 0,082 L atm/mol K-1
Ditanya : α ?
NaCl Na+ + Cl–
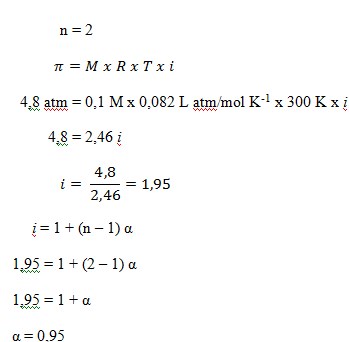
44. Suatu larutan elektrolit biner, 0,5 molal membeku pada suhu -1,55o jika nilai Kf = 1,86oC/molal, derajat ionisasi larutan elektrolit tersebut adalah ….
a. 0,33
b. 0,42
c. 0,66
d. 0,83
e. 0,99
(SPM, Mustafal Bakri, Esis, 2008, Hal 107)
JAWABAN : C
PEMBAHASAN
Diketahui:
- m = 0,5
- Kf = 1,86oC/molal
- ΔTf = 0 – (-1,55) = 1,55oC
- Elektrolit niner (n = 2)
Ditanya : α ?
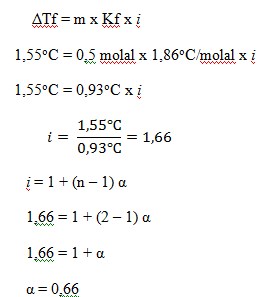
45. Tekanan osmosis rata-rata dalam darah adalah 7,7 atm pada suhu 25o maka konsentrasi glukosa (C6H12O6) yang bersifat isotonik dengan darah adalah ….
a. 0,31 M
b. 0,59 M
c. 1,65 M
d. 3,18 M
e. 3,75 M
JAWABAN : A
Diketahui:
- = 7,7 atm
- T = 25oC + 273 = 298 K
- R = 0,082 L atm/mol K-1
Ditanya : Konsentrasi (M) ?


Tidak ada komentar:
Posting Komentar