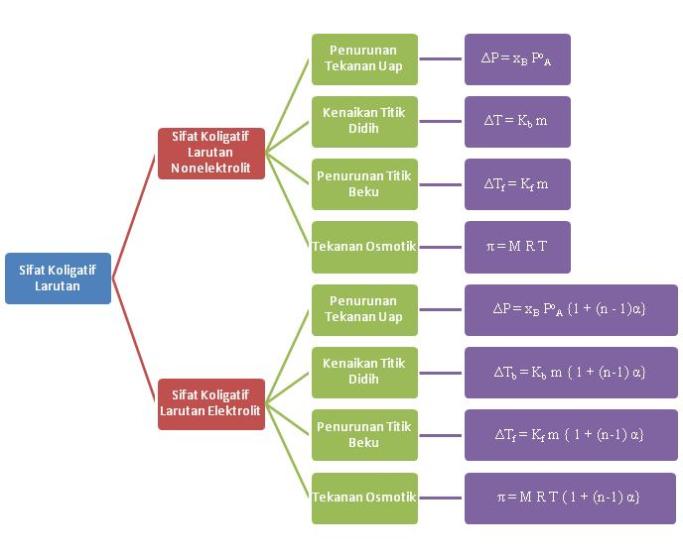
Sifat koligatif larutan ditentukan oleh banyaknya partikel zat terlarut.
Molalitas dan Fraksi Mol
1. Molalitas (m)
Yaitu jumlah partikel zat terlarut (mol) setiap 1 kg zat pelarut (bukan larutan). Sehingga dapat didefinisikan dengan persamaan berikut:
Molalitas dapat diukur pada saat pelarut dalam wujud padatan dan hanya dapat diukur massanya, bukan volumenya sehingga tidak mungkin dinyatakan dalam bentuk molaritas.
Contoh :
1. Sebanyak 30 gr urea (Mr = 60 gr/mol) dilarutkan ke dalam 100 g air. Hitunglah molalitas larutan.
Jawab :
2. Berapa gram NaCl yang harus dilarutkan dalam 500 g air untuk menghasilkan larutan 0,15 m?
Jawab :
3. Berapakah kemolaran dari larutan 10% (w/w) NaCl ? (w/w = persen berat)
Jawab :
2. Fraksi Mol
Merupakan satuan konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol.
Contoh :
1. Larutan glukosa dibuat dengan melarutkan 18 gr glukosa ( Mr = 180 gr/mol ) ke dalam 250 gr air. Hitunglah fraksi mol glukosa.
Jawab :
2. Berapa fraksi mol dan persen mol setiap komponen dari campuran 0,2 mol O2 dan 0,5 mol N2?
Jawab :
Sifat Koligatif Larutan Nonelektrolit
1. Penurunan Tekanan Uap
Penguapan adalah peristiwa yang terjadi ketika partikel-partikel zat cair meninggalkan kelompoknya.
Semakin lemah gaya tarik-menarik antarmolekul zat cair, semakin mudah zat cair tersebut mudah menguap. Semakin mudah zat cair menguap, semakin besar pula tekanan uap jenuhnya.
Dalam suatu larutan, partikel-partikel zat terlarut menghalangi gerak molekul pelarut untuk berubah sari bentuk cair menjadi bentuk uap sehingga tekanan uap jenuh larutan menjadi lebih rendah dari tekanan uap jenuh larutan murni.
Hukum Raoult :
Keterangan :
∆P : perbedaan tekanan uap larutan murni dengan tekanan uap zat pelarut
Xt : fraksi mol zat terlarut
Xp : fraksi mol zat pelarut
Pp : tekanan uap zat pelarut
Pt : tekanan uap zat terlarut
Tekanan uap total :
Contoh :
1. Hitunglah tekanan uap larutan 2 mol sukrosa dalam 50 mol air pada 300oC jika tekanan uap air murni pada 300oC adalah 31,80 mmHg.
Jawab :
Yang ditanya dalam soal ini adalah tekanan uap air murni. Jadi, yang dicari adalah tekanan uap pelarut murni atau Pp.
2. Berapakah tekanan uap parsial dan tekanan uap total pada suhu 25oC di atas larutan dengan jumlah fraksi mol benzena (C6H8) sama dengan jumlah fraksi mol toleuna (C7H8)? Tekanan uap benzene dan toluene pada suhu 25oC berturut-turut adalah 95,1 mmHg dan 28,4 mmHg.
Jawab :
Jika larutan terdiri atas dua komponen dengan jumlah fraksi mol yang sama, maka :
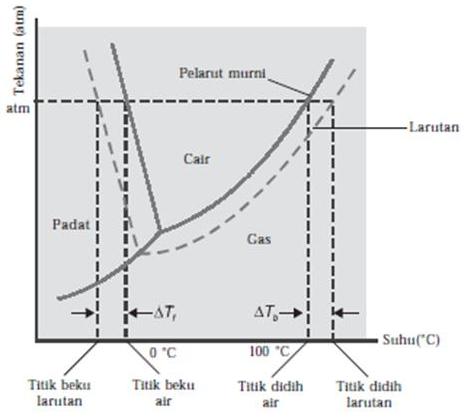
2. Kenaikan Titik Didih dan Penurunan Titik Beku
Dari gambar di atas dapat dilihat bahwa :
Adanya zat terlarut pada suatu larutan menyebabkan penurunan tekanan uap yang mengakibatkan terjadinya penurunan garis kesetimbangan antarfase sehingga terjadi kenaikan titik didih dan penurunan titik beku.
a. Kenaikan Titik Didih (∆Tb)
Titik didih zat cair adalah suhu tetap pada saat zat cair mendidih dimana tekana uap zat cair sama dengan tekanan uap udara disekitarnya yaitu 1 atm. Dan harus diingat titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya. Hal ini disebabkan adanya partikel-partikel zat terlarut dalam suatu larutan yang menghalangi peristiwa penguapan partikel-partikel pelarut. Perbedaan titik didih alrutan dengan titik didih pelarut murni disebut kenaikan titik didih yang dinyatakan sebagai ∆Tb ( b berasal dari kata boil yang artinya mendidih, bukan beku).
Titik didih suatu larutan lebih tinggi atau rendah daripada titik didih pelarut, bergantung pada kemudahan zat terlarut itu menguap dibandingkan dengan pelarutnya. Jika zat terlarut tersebut tidak mudah menguap, misalnya larutan gula, larutan tersebut mendidih pada suhu yang lebih tinggi daripada titik didih pelarut air. Sebaliknya, jika zat terlarut itu mudah menguap misalnya etanol, larutan akan mendidih pada suhu di bawah titik didih air.
Hukum sifat koligatif dapt diterapkan dalam meramalkan titik didih larutan yang zat terlarutnya bukan elektrolit dan tidak mudah menguap.
Dengan :
Kb : tetapan kenaikan titik molal dari pelarut (oC/m)
∆Tb : kenaikan titik didih
Tb : titik didih larutan
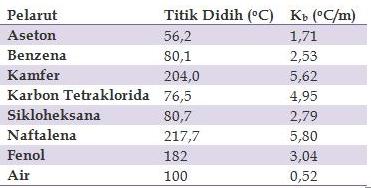
Tetapan Kenaikan Titik Didih (Kb) Beberapa Pelarut
Contoh :
1. Hitunglah titik didih larutan yang mengandung 18 gr glukosa C6H12O6. (Ar C = 12 gr/mol; H = 1 gr/mol; O = 16 gr/mol) dalam 250 gr air. (Kb air adalah 0,52 oC/m)
Jawab :
2. Titik didih larutan yang mengandung 1,5 gr gliserin dalam 30 gr air adalah 100,28 oC. Tentukan massa molekul relatif gliserin. (Kb air = 0,52 oC/m)
Jawab :
b. Penurunan Titik Beku (∆Tf)
Adanya zat terlarut dalam larutan akan mengakibatkan titik beku larutan lebih kecil daripada titik beku pelarutnya. Penurunan titik beku, ∆Tf (f berasal dari kata freeze) yang berbanding lurus dengan molaritas.
∆Tf = Penurunan titik beku
Kf = tetapan penuruan titik beku molal pelarut (oC/m)
Tof = titik beku pelarut murni
Tf = titik beku larutan
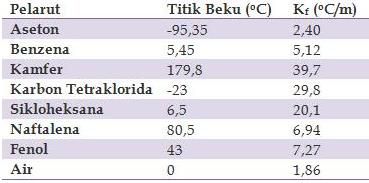
Tetapan Penurunan Titik Beku (Kf) Beberapa Pelarut
Contoh :
1. Berapakan titik beku larutan yang terbuat dari 10 gr urea CO(NH2) dalam 100 gr air? ( Mr urea = 60 gr/mol; Kf air = 1,86 oC/m)
Jawab :
2. Hitunglah titik beku suatu larutan yang mengandung 2 gr kloroform, CHCl3 (Mr = 119 gr/mol) yang dilarutkan dalam 50 benzena (Kf benzene = 5,12 oC/m; Tf benzene = 5,45 oC/m)
Jawab :
3. Larutan yang dibuat dengan melarutkan 5,65 gr suatu senyawa yang tidak diketahui dalam 110 gr benzena (Tf benzena = 5,45 oC) membeku pada 4,39 oC. Berapakan massa molar senyawa tersebut?
Jawab :
3. Tekanan Osmotik
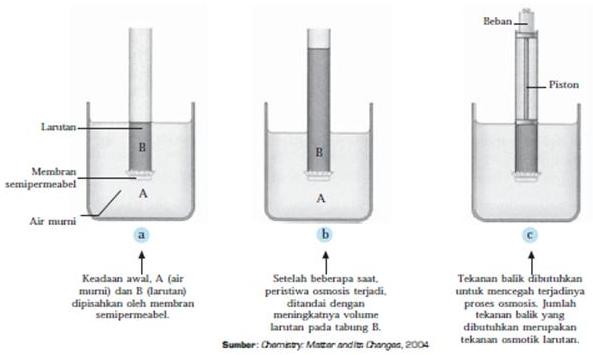
Osmosis adalah merembesnya partikel-partikel pelarut dari larutan yang lebih encer ke larutan yang lebih pekat melalui suatu membran semipermeabel. Membran semipermeabel hanya melewatkan molekul zat tertentu sementara zat yang lainnya tertahan.
Gambar di atas merupakan peristiwa osmosis. Pada gambar (a), diperlihatkan keadaan awal, kemudian setelah beberapa saat, tinggi air pada tabung naik (gambar (b)) hingga kesetimbangan tercapai. Tekanan balik dibutuhkan untuk mencegah terjadinya proses osmosis (gambar (c)). Jumlah tekanan balik yang dibutuhkan merupakan tekanan osmotik larutan.
Dua larutan yang memiliki tekanan osmotik yang sama disebut larutan isotonik. Jika salah satu larutan memiliki tekanan osmotik lebih tinggi dari larutan yang lainnya disebut hipertonik. Adapun jika larutan memiliki tekanan osmotik lebih rendah dari larutan yang lainnya, larutan tersebut dinamakan hipotonik.
Persamaan Van’t Hoff digunakan utnuk menghitung tekanan osmotik :
Dengan :
p : tekanan osmotik (atm)
R : tetapan gas (0,082 L atm/mol K)
M : molaritas larutan
T : suhu (Kelvin)
Contoh :
1. Berapakah tekanan osmotik pada 25oC dari larutan sukrosa 0,001 M?
Jawab :
2. Dalam larutan encer, 0,001 M gula dalam air dipisahkan dari air murni dengan menggunakan membran osmosis. Berapakah tekanan osmotik dalam torr pada suhu 25oC?
Jawab :
3. Suatu larutan dengan volume 100 mL mengandung 0,1222 gr zat non elektrolit terlarut dan memiliki tekanan osmotik 16 torr pada suhu 20oC. Berapakah massa molar zat terlarut tersebut?
Jawab :
Osmosis terbalik adalah suatu cara untuk memulihkan pelarut murni dari dalam suatu larutan. Contohnya adalah pemulihan air murni dari limbah industry dan menawarkan air laut (desalinasi).
Sifat Koligatif Larutan Elektrolit
Menurut Arhenius, suatu zat elektrolit yang dilarutkan dalam air akan terurai menjadi ion-ion penyusunnya sehingga jumlah partikel zat pada larutan elektrolit akan lebih banyak dibandingkan dengan larutan nonelektrolit yang konsentrasinya sama. Hal ini menyebabkan sifat koligatif pada larutan elektrolit lebih besar daripada larutan nonelektrolit.
Hubungan sifat koligatif larutan elektrolit dan konsentrasi larutan dirumuskan oleh Van’t Hoff, yaitu dengan mengalikan rumus yang ada dengan bilangan faktor Van’t Hoff yang merupakan faktor penambahan jumlah partikel dalam larutan elektrolit.
Keterangan :
i : factor yang menunjukkan bagaimana larutan elektrolit dibandingkan dengan larutan nonelektrolit dengan molalitas yang sama. Faktor i inilah yang lebih lanjut disebut faktor Van’t Hoff.
n : jumlah ion dari elektrolit
α : derajat ionisasi elektrolit
Contoh elektrolit biner:
NaCl(s) ---> Na+(aq) + Cl–(aq) (n = 2)
KOH(s) ---> K+(aq) + OH–(aq) (n = 2)
Contoh elektrolit terner:
H2SO4(l) + 2 H2O(l) ---> 2 H3O+(aq) + SO42–(aq) (n = 3)
Mg(OH)2(s) ---> Mg2+(aq) + 2 OH–(aq) (n = 3)
Contoh elektrolit kuarterner:
K3PO4(s) ----> 3 K+(aq) + PO43–(aq) (n = 4)
AlBr3(s)-----> Al3+(aq) + 3 Br–(aq) (n = 4)
Untuk larutan elektrolit berlaku Hukum Van’t Hoff
1. Penurunan Tekanan Uap Jenuh
Rumus penurunan tekanan uap jenuh dengan memakai faktor Van’t Hoff hanya berlaku untuk fraksi mol zat terlarutnya saja (zat elektrolit yang mengalami ionisasi), sedangkan pelarut air tidak terionisasi. Oleh karena itu, rumus penurunan tekanan uap jenuh untuk zat elektrolit adalah:
Contoh :
1. Hitunglah tekanan uap larutan NaOH 0,2 mol dalam 90 gram air jika tekanan uap air pada suhu tertentu adalah 100 mmHg.
Jawab :
2. Kenaikan Titik Didih dan Penuruan Titik Beku
Seperti halnya penurunan tekanan uap jenuh, rumus untuk kenaikan titik didih dan penurunan titik beku untuk larutan elektrolit juga dikalikan dengan faktor Van’t Hoff.
Contoh : Sebanyak 4,8 gram magnesium sulfat, MgSO4 (Mr = 120 g/mol) dilarutkan dalam 250 g air. Larutan ini mendidih pada suhu 100,15 °C. Jika diketahui Kb air 0,52 °C/m, Kf air = 1,8 °C/m, tentukan:
a. Derajat ionisasi MgSO4
b. Titik beku larutan
Jawab :
3. Tekanan Osmotik
Tekanan osmotik untuk larutan elektrolit diturunkan dengan mengalikan faktor van’t Hoff.
Contoh :
1. Sebanyak 5,85 gram NaCl (Mr = 58,5 g/mol) dilarutkan dalam air sampai volume 500 mL. Hitunglah tekanan osmotik larutan yang terbentuk jika diukur pada suhu 27 °C dan R = 0,082 L atm/mol K.
Jawab:
2. Sebanyak 38 g elektrolit biner (Mr = 95 g/mol) dilarutkan dalam air sampai dengan volume 1 L pada suhu 27 °C dan memiliki tekanan osmotik 10 atm. Hitunglahderajat ionisasi elektrolit biner tersebut.
Jawab :
Baca : Soal dan Pembahasan Sifat Koligatif Larutan
Klik LINK untuk mengerjakan PR


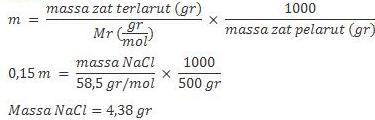


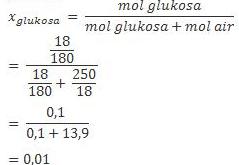

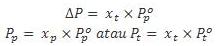
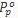
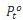
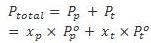
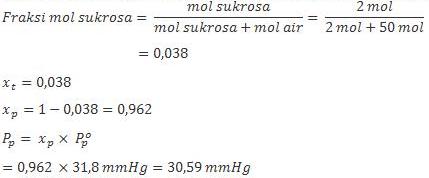

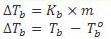

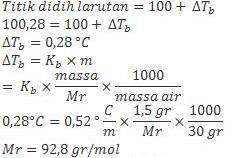
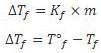



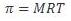
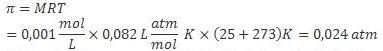
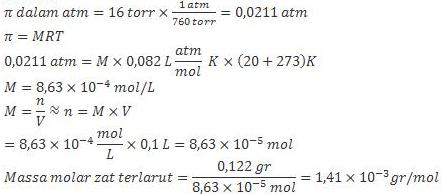
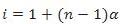
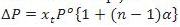
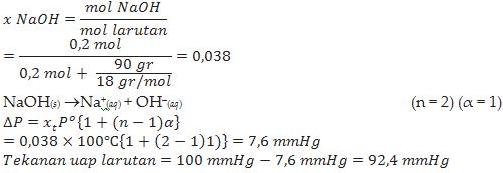
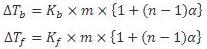
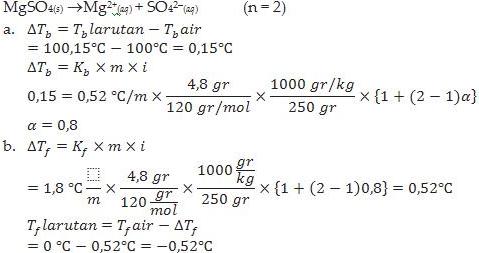
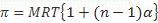
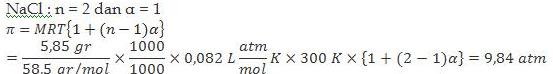
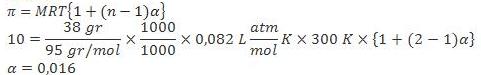


Tidak ada komentar:
Posting Komentar