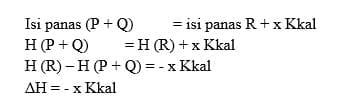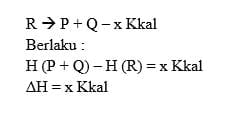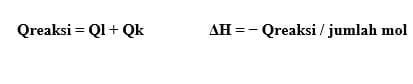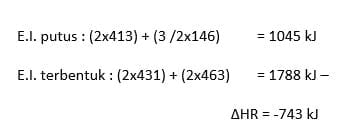Termokimia : Pengertian, Persaman, Reaksi, Rumus Dan Contoh Soal
Diposting pada
Pengertian Termokimia
Termokimia yang merupakan bagian dari Termodinamika membahas tentang perubahan energi yang menyertai suatu reaksi kimia yang dimanifestasikan sebagai kalor reaksi. Partikel-partikel penyusun zat selalu bergerak konstan, sehingga zat memiliki energi kinetik. Energi kinetik rata-rata suatu objek berbanding lurus dengan temperature absolutnya (0K).
ini berarti jika suatu objek dalam keadaan panas, atom-atom molekulnya-molekul penyusun objek tersebut bergerak cepat, sehingga energy kinetic objek tersebut besar. Energi potensial suatu zat muncul dari gaya tarik menarik dan tolak-menolak antara partikel-partikel penyusun zat. Salah satu bentuk energi yang umum dijumpai adalah energi kalor.
Kalor adalah salah satu bentuk energi yang dapat dipertukarkan antara sistem dan lingkungan. Kalor reaksi adalah perubahan energi dalam reaksi kimia dalam bentuk kalor. Secara umum untuk mendeteksi adanya kalor yang dimiliki oleh suatu benda yaitu dengan mengukur suhu benda tersebut. Jika suhunya tinggi maka kalor yang dikandung oleh benda sangat besar, begitu juga sebaliknya jika suhunya rendah maka kalor yang dikandung sedikit.
Alat untuk mengukur kalor reaksi dari suatu reaksi kimia adalah kalorimeter. Kalorimeter yang menggunakan teknik pencampuran dua zat didalam suatu wadah, umumnya digunakan untuk menentukan kalor jenis suatu zat. Ada dua jenis kalorimeter yaitu kalorimeter volume tetap dan kalorimeter tekanan tetap.
Termokimia merupakan penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia.
Termokimia dapat didefinisikan sebagai bagian ilmu kimia yang mempelajari dinamika atau perubahan reaksi kimia dengan mengamati panas/termalnya saja. Salah satu terapan ilmu ini dalam kehidupan sehari-hari ialah reaksi kimia dalam tubuh kita dimana produksi dari energi-energi yang dibutuhkan atau dikeluarkan untuk semua tugas yang kita lakukan. Pembakaran dari bahan bakar seperti minyak dan batu bara dipakai untuk pembangkit listrik.
Dengan kajian-kajian yang dilakukan mengenai pengaplikasian termokimia dalam kehidupan sehari-hari. Dan untuk menguraikan permasalahan tersebut lebih detail lagi, penulis mencoba membuat makalah yang isinya membahas tentang “Aplikasi Termokimia Dalam Kehidupan Sehari-hari”.
Persamaan Termokimia
- Adalah persamaan reaksi yang mengikutsertakan perubahan entalpinya ( DH ).
- Nilai DH yang dituliskan di persamaan termokimia, disesuaikan dengan stoikiometri reaksinya, artinya = jumlah mol zat yang terlibat dalam reaksi kimia = koefisien reaksinya; ( fase reaktan maupun produk reaksinya harus dituliskan).
Contoh Soal :
Pada pembentukan 1 mol air dari gas hidrogen dengan oksigen pada 298 K, 1 atm dilepaskan kalor sebesar 285, 5 kJ.
Persamaan termokimianya :
Jika koefisien dikalikan 2, maka harga DH reaksi juga harus dikalikan 2.
- Beberapa hal yang harus diperhatikan dalam menuliskan persamaan termokimia :
- Koefisien reaksi menunjukkan jumlah mol zat yang terlibat dalam reaksi.
- Ketika persamaan reaksinya dibalik ( mengubah letak reaktan dengan produknya ) maka nilai DH tetap sama tetapi tandanya berlawanan.
- Jika kita menggandakan kedua sisi persamaan termokimia dengan faktor y maka nilai DH juga harus dikalikan dengan faktor y tersebut.
- Ketika menuliskan persamaan reaksi termokimia, fase reaktan dan produknya harus dituliskan.
Perubahan Energi Dalam Reaksi Kimia
Hampir dalam setiap reaksi kimia akan selalu terjadi penyerapan dan pelepasan energi. Apabila perubahan kimia terjadi pada wadah sekat, sehingga tidak ada kalor yang masuk maupun keluar dari sistem. Dengan demikian energy total yang dimiliki sistem adalah tetap. Perubahan energi dalam reaksi kimia ada dua yaitu perubahan endoterm dan perubahan eksoterm. Perubahan endorterm adalah perubahan yang mampu mengalirkan kalor dari sistem ke lingkungan atau melepaskan kalor ke lingkungan.
Bila perubahan eksoterm terjadi temperatur sistem meningkat, energi potensial zat-zat yang terlibat dalam reaksi menurun. Sedangkan perubahan eksoterm adalah kalor yang akan mengalir ke dalam sistem. Bila suatu perubahan endoterm terjadi, temperatur sistem menurun, energi potensial zat-zat yang terlibat dalam reaksi akan meningkat.
Kapasitas Kalor dan Kalor Jenis
Kapasitas kalor (C) adalah jumlah kalor yang diperlukan untuk menaikkan temperatur dari suatu sampel bahan sebesar 1 Co. Secara matematis dinyatakan dengan persamaan berikut :
DQ = C DT
Kalor jenis (s) adalah jumlah kalor yang diperlukan untuk menaikkan temperatur dari 1 gr massa bahan sebesar 1 Co. Jika kita mengetahui kalor jenis dan jumlah suatu zat, maka perubahan temperatur zat tersebut () dapat menyatakan jumlah kalor (q) yang diserap atau dilepaskan dalam suatu reaksi kimia.
Keterangan:
q = kalor yang dilepas atau diserap (J)
= perubahan temperatur (takhir – tawal) (0C)
Hubungan antara kapasitas kalor dengan kalor jenis dirumuskan sebagai berikut :
Keterangan:
C = kapasitas kalor (J/0C)
m = massa sampel (gr)
c = kalor jenis (J/g0C)
Entalpi
Entalpi (H) adalah jumlah total dari semua bentuk energi. Entalpi (H) suatu zat ditentukan oleh jumlah energi dan semua bentuk energi yang dimiliki zat yang jumlahnya tidak dapat diukur dan akan tetap konstan selama tidak ada energi yang masuk atau keluar dari zat. Energi kinetik ditimbulkan karena atom – atom dan molekul molekul dalam zat bergerak secara acak. Jumlah total dari semua bentuk energi itu disebut entalpi (H) . Entalpi akan tetap konstan selama tidak ada energi yang masuk atau keluar dari zat. Misalnya entalpi untuk air dapat ditulis H H20 (l) dan untuk es ditulis H H20 (s).
Untuk menyatakan kalor reaksi pada tekanan tetap (qp ) digunakan besaran yang disebut Entalpi ( H ).
H = E + ( P.V )
DH = DE + ( P. DV )
DH = (q + w ) + ( P. DV )
DH = qp – ( P. DV ) + ( P. DV )
DH = qp
Untuk reaksi kimia :
DH = Hp – Hr
Hp = entalpi produk
Hr = entalpi reaktan
Reaksi pada tekanan tetap : qp = DH ( perubahan entalpi )
Reaksi pada volume tetap : qv = DE ( perubahan energi dalam )
Perubahan kalor atau entalpi yang terjadi selama proses penerimaan atau pelepasan kalor dinyatakan dengan ” perubahan entalpi (ΔH) ” . Harga entalpi zat sebenarnya tidak dapat ditentukan atau diukur. Tetapi ΔH dapat ditentukan dengan cara mengukur jumlah kalor yang diserap sistem. Misalnya pada perubahan es menjadi air, yaitu 89 kalori/gram.
Pada perubahan es menjadi air, ΔH adalah positif, karena entalpi hasil perubahan, entalpi air lebih besar dari pada entalpi es. Pada perubahan kimia selalu terjadi perubahan entalpi. Besarnya perubahan entalpi adalah sama besar dengan selisih antara entalpi hasil reaksi dan jumlah entalpi pereaksi.
Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Energi potensial berkaitan dengan wujud zat, volume, dan tekanan. Energi kinetik ditimbulkan karena atom – atom dan molekul-molekul dalam zat bergerak secara acak. Jumlah total dari semua bentuk energi itu disebut entalpi (H) . Entalpi akan tetap konstan selama tidak ada energi yang masuk atau keluar dari zat. . Misalnya entalpi untuk air dapat ditulis H H20 (l) dan untuk es ditulis H H20 (s).
Entalpi (H) suatu zat ditentukan oleh jumlah energi dan semua bentuk energi yang dimiliki zat yang jumlahnya tidak dapat diukur. Perubahan kalor atau entalpi yang terjadi selama proses penerimaan atau pelepasan kalor dinyatakan dengan ” perubahan entalpi (ΔH) ” . Misalnya pada perubahan es menjadi air, maka dapat ditulis sebagai berikut:
Δ H = H H20 (l) -H H20 (s)
Apabila kita amati reaksi pembakaran bensin di dalam mesin motor. Sebagian energi kimia yang dikandung bensin, ketika bensin terbakar, diubah menjadi energi panas dan energi mekanik untuk menggerakkan motor. Demikian juga pada mekanisme kerja sel aki. Pada saat sel aki bekerja, energi kimia diubah menjadi energi listrik, energi panas yang dipakai untuk membakar bensin dan reaksi pembakaran bensin menghasilkan gas, menggerakkan piston sehingga menggerakkan roda motor.
Harga entalpi zat sebenarnya tidak dapat ditentukan atau diukur. Tetapi ΔH dapat ditentukan dengan cara mengukur jumlah kalor yang diserap sistem. Misalnya pada perubahan es menjadi air, yaitu 89 kalori/gram. Pada perubahan es menjadi air, ΔH adalah positif, karena entalpi hasil perubahan, entalpi air lebih besar dari pada entalpi es.
Termokimia merupakan bagian dari ilmu kimia yang mempelajari perubahan entalpi yang menyertai suatu reaksi. Pada perubahan kimia selalu terjadi perubahan entalpi. Besarnya perubahan entalpi adalah sama besar dengan selisih antara entalpi hasil reaksi dam jumlah entalpi pereaksi.
Pada reaksi endoterm, entalpi sesudah reaksi menjadi lebih besar, sehingga ΔH positif. Sedangkan pada reaksi eksoterm, entalpi sesudah reaksi menjadi lebih kecil, sehingga ΔH negatif. Perubahan entalpi pada suatu reaksi disebut kalor reaksi. Kalor reaksi untuk reaksi-reaksi yang khas disebut dengan nama yang khas pula, misalnya kalor pembentukan,kalor penguraian, kalor pembakaran, kalor pelarutan dan sebagainya.
Entalpi Pembentukan Standar (ΔH◦f)
Entalpi pembentukan standar suatu senyawa menyatakan jumlah kalor yang diperlukan atau dibebaskan untuk proses pembentukan 1 mol senyawa dari unsur-unsurnya yang stabil pada keadaan standar (STP). Entalpi pembentukan standar diberi simbol (ΔH◦f), simbol f berasal dari kata formation yang berarti pembentukan. Contoh unsur-unsur yang stabil pada keadaan standar, yaitu : H2,O2,C,N2,Ag,Cl2,Br2,S,Na,Ca, dan Hg.
Entalpi Penguraian Standar (ΔH◦d)
Entalpi penguraian standar suatu senyawa menyatakan jumlah kalor yang diperlukan atau dibebaskan untuk proses penguraian 1 mol senyawa dari unsure-unsurnya yang stabil pada keadaan standar (STP). Entalpi penguraian standar diberi simbol (ΔH◦d) simbol d berasal dari kata decomposition yang berarti penguraian.
Menurut Hukum Laplace, jumlah kalor yang dibebaskan pada pembentukan senyawa dari unsur-unsurnya sama dengan jumlah kalor yang diperlukan pada penguraian senyawa tersebut menjadi unsur-unsurnya. Jadi, entalpi penguraian merupakan kebalikan dari entalpi pembentukan senyawa yang sama. Dengan demikian jumlah kalornya sama tetapi tandanya berlawanan karena reaksinya berlawanan arah.
Entalpi Pembakaran Standar (ΔH◦c)
Entalpi pembakaran standar suatu senyawa menyatakan jumlah kalor yang diperlukan atau dibebaskan untuk proses pembakaran 1 mol senyawa dari unsur-unsurnya yang stabil pada keadaan standar (STP). Entalpi penguraian standar diberi simbol (ΔH◦c) simbol d berasal dari kata combustion yang berarti pembakaran.Pembakaran selalu membebaskan kalor sehingga nilai entalpipembakaran selallu negatif (eksoterm)
Entalpi Pelarutan Standar (ΔH◦s)
Entalpi pelarutan standar menyatakan jumlah kalor yang diperlukan atau dibebaskan untuk melarutkan 1 mol zat pada keadaan standar (STP). Entalpi penguraian standar diberi simbol (ΔH◦s) simbol s berasal dari kata solvation yang berarti pelarutan.
Entalpi Netralisasi Standar
Adalah entalpi yang terjadi pada penetralan 1 mol asam oleh basa atau 1 mol basa oleh asam pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHn. Satuannya = kJ / mol
Entalpi Penguapan Standar
Adalah entalpi yang terjadi pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHvap. Satuannya = kJ / mol.
Entalpi Peleburan Standar
Adalah entalpi yang terjadi pada pencairan / peleburan 1 mol zat dalam fase padat menjadi zat dalam fase cair pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHfus. Satuannya = kJ / mol.
Entalpi Sublimasi Standar
Adalah entalpi yang terjadi pada sublimasi 1 mol zat dalam fase padat menjadi zat dalam fase gas pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHsub. Satuannya = kJ / mol.
Kalorimeter
Kalorimetri yaitu cara penentuan kalor reaksi dengan menggunakan kalorimeter.Perubahan entalpi adalah perubahan kalor yang diukur pada tekanan konstan, untuk menentukan perubahan entalpi dilakukan dengan cara yang sama dengan penentuan perubahan kalor yang dilakukan pada tekanan konstan. Perubahan kalor pada suatu reaksi dapat diukur melalui pengukuran perubahan suhu yang terjadi pada reaksi tersebut. Pengukuran perubahan kalor dapat dilakukan dengan alat yang disebut kalorimeter.
Kalorimeter adalah suatu sistem terisolasi ( tidak ada perpindahan materi maupun energi dengan lingkungan di luar kalorimeter ). Kalorimeter terbagi menjadi dua, yaitu kalorimeter bom dan kalorimeter sederhana. Jika dua buah zat atau lebih dicampur menjadi satu maka zat yang suhunya tinggi akan melepaskan kalor sedangkan zat yang suhunya rendah akan menerima kalor, sampai tercapai kesetimbangan termal.
Menurut azas Black : Kalor yang dilepas = kalor yang diterima
Rumus yang digunakan adalah :
dengan :
q = jumlah kalor ( J )
m = massa zat ( g )
DT = perubahan suhu ( oC atau K )
c = kalor jenis ( J / g.oC ) atau ( J / g. K )
C = kapasitas kalor ( J / oC ) atau ( J / K )
Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka kalor reaksi = kalor yang diserap / dibebaskan oleh larutan dan kalorimeter, tetapi tandanya berbeda.
Beberapa jenis kalorimeter :
Kalorimeter bom
Kalorimeter bom adalah alat yang digunakan untuk mengukur jumlah kalor (nilai kalori) yang dibebaskan pada pembakaran sempurna (dalam O2 berlebih) suatu senyawa, bahan makanan, bahan bakar atau khusus digunakan untuk menentukan kalor dari reaksi-reaksi pembakaran. Kalorimeter ini terdiri dari sebuah bom (tempat berlangsungnya reaksi pembakaran, terbuat dari bahan stainless steel dan diisi dengan gas oksigen pada tekanan tinggi ) dan sejumlah air yang dibatasi dengan wadah yang kedap panas.
Sejumlah sampel ditempatkan pada tabung beroksigen yang tercelup dalam medium penyerap kalor (kalorimeter), dan sampel akan terbakar oleh api listrikdari kawat logam terpasang dalam tabung. Reaksi pembakaran yang terjadi di dalam bom, akan menghasilkan kalor dan diserap oleh air dan bom. Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka :
Jumlah kalor yang diserap oleh air dapat dihitung dengan rumus :
qair = m x c x DT
dengan :
m = massa air dalam kalorimeter ( g )
c = kalor jenis air dalam kalorimeter (J / g.oC ) atau ( J / g. K )
DT = perubahan suhu ( oC atau K )
Jumlah kalor yang diserap oleh bom dapat dihitung dengan rumus :
qbom = Cbom x DT
dengan :
Cbom = kapasitas kalor bom ( J / oC ) atau ( J / K )
DT = perubahan suhu ( oC atau K )
Reaksi yang berlangsung pada kalorimeter bom berlangsung pada volume tetap (DV = nol ). Oleh karena itu, perubahan kalor yang terjadi di dalam sistem = perubahan energi dalamnya.
DE = q + w dimana w = – P. DV ( jika DV = nol maka w = nol )
maka DE = qv
Kalorimeter makanan adalah alat untuk menentukan nilai kalor zat makanankarbohidrat, protein, atau lemak. Alat ini terdiri dari sebuah tabung kaca yang tingginya kurang lebih 19 cm dan garis menengahnya kurang lebih 7,5 cm. Bagian dasarnya melengkung ke atas membentuk sebuah penyungkup. Penyungkup ini disumbat dengan sebuah sumbat karet yang yang berlubang di bagian tengah. Bagian atas tabung kaca ini ditutup dengan lempeng ebonit yang bundar.
Di dalam tabung kaca itu terdapat sebuah pengaduk, yang tangkainya menembus tutup ebonit, juga terdapat sebuah pipa spiraldari tembaga. Ujung bawah pipa spiral itu menembus lubang sumbat karet pada penyungkup dan ujung atasnya menembus tutup ebonit bagian tengah. Pada tutup ebonit itu masih terdapat lagi sebuah lubang, tempat untuk memasukkan sebuah termometer ke dalam tabung kaca.
Tabung kaca itu diletakkan di atas sebuah kepingasbes dan ditahan oleh 3 buah keping. Keping itu berbentuk bujur sangkar yang sisinya kurang lebih 9,5 cm. Di bawah keping asbes itu terdapat kabel listrik yang akan dihubungkan dengan sumber listrik bila digunakan. Di atas keping asbes itu terdapat sebuah cawan aluminium. Di atas cawan itu tergantung sebuah kawat nikelin yang berhubungan dengan kabel listrik di bawah keping asbes. Kawat nikelin itulah yang akan menyalakan makanan dalam cawan bila berpijar oleh arus listrik. Dekat cawan terdapat pipa logam untuk mengalirkan oksigen.
Kalorimeter Sederhana
Pengukuran kalor reaksi; selain kalor reaksi pembakaran dapat dilakukan dengan menggunakan kalorimeter pada tekanan tetap yaitu dengan kalorimeter sederhana yang dibuat dari gelas stirofoam. Kalorimeter ini biasanya dipakai untuk mengukur kalor reaksi yang reaksinya berlangsung dalam fase larutan ( misalnya reaksi netralisasi asam – basa / netralisasi, pelarutan dan pengendapan ).
Pada kalorimeter ini, kalor reaksi = jumlah kalor yang diserap / dilepaskan larutan sedangkan kalor yang diserap oleh gelas dan lingkungan; diabaikan.
qreaksi = – (qlarutan + qkalorimeter )
qkalorimeter = Ckalorimeter x DT
dengan :
Ckalorimeter = kapasitas kalor kalorimeter ( J / oC ) atau ( J / K )
DT = perubahan suhu ( oC atau K )
Jika harga kapasitas kalor kalorimeter sangat kecil; maka dapat diabaikan sehingga perubahan kalor dapat dianggap hanya berakibat pada kenaikan suhu larutan dalam kalorimeter.
qreaksi = – qlarutan
qlarutan = m x c x DT
dengan :
m = massa larutan dalam kalorimeter ( g )
c = kalor jenis larutan dalam kalorimeter (J / g.oC ) atau ( J / g. K )
DT = perubahan suhu ( oC atau K )
Pada kalorimeter ini, reaksi berlangsung pada tekanan tetap (DP = nol ) sehingga perubahan kalor yang terjadi dalam sistem = perubahan entalpinya.
DH = qp
Kalorimeter larutan adalah alat yang digunakan untuk mengukur jumlah kaloryang terlibat pada reaksi kimia dalam sistem larutan. Pada dasarnya, kalor yang dibebaskan/diserap menyebabkan perubahan suhu pada kalorimeter. Berdasarkan perubahan suhu per kuantitas pereaksi kemudian dihitung kalor reaksi dari reaksi sistem larutan tersebut. Kini kalorimeter larutan dengan ketelitian cukup tinggi dapat diperoleh dipasaran.
Dalam menentukan entalpi berlaku persamaan
Qreaksi = – (Qlarutan + Q kalorimeter )
Q reaksi = – (m.c.∆T + c.∆T)
Jika kapasitas kalori dalam kalorimeter diabaikan, maka
Qreaksi = – (m.c.∆T)
Keterangan :
m = massa zat (kg)
c = kalor jenis (J/kg⁰C)
∆t = perubahan suhu (Celcius)
Sementara itu, persamaan reaksi yang mengikutsertakan perubahan entalpinya disebut persamaan termokimia.
H2 (g) + 1/2 O2 (g) ——> H2O (l) ΔH = -286 kJ
Pada reaksi endoterm, sistem menyerap energi. Oleh karena itu, entalpi sistem akan bertambah. Artinya entalpi produk (Hp) lebih besar daripada entalpi pereaksi (Hr). Akibatnya, perubahan entalpi, merupakan selisih antara entalpi produk dengan entalpi pereaksi (Hp -Hr) bertanda positif. Sehingga perubahan entalpi untuk reaksi endoterm dapat dinyatakan:
ΔH = Hp- Hr > 0
Reaksi eksoterm , sistem membebaskan energi, sehingga entalpi sistem akan berkurang, artinya entalpi produk lebih kecil daripada entalpi pereaksi. Oleh karena itu , perubahan entalpinya bertanda negatif. Sehingga p dapat dinyatakan sebagai berikut:
ΔH = Hp- Hr < 0
Manfaat Termokimia
- Dapat mempelajari suatu bentuk energi yang dibutuhkan oleh manusia untuk bergerak dalam bentuk energi kinetik dan tambahan-tambahan dalam melakukan proses fotosintesis yang membutuhkan energi dari sinar matahari.
- Dapat mempelajari suatu sistem atau bagian alam semasta yang menjadi objek penelitian serta lingkungan atau bagian alam semesta yang berinteraksi dengan satu sistem.
Aplikasi Termokimia Dalam Kehidupan Sehari-Hari
Gas Elpiji
Penggunaan elpiji pada kompor gas. Utamanya adalah butana bereaksi dengan udara.
C4H10 + Udara –> CO2 + H20 + N2
Untuk mempermudah udara sepenuhnya bergantung dari oksigen.
C4H10 + (13/2)O2 –> 4CO2 + 5H2O
Untuk reaksi sempurna dengan udara,
C4H10 + (O2 + 3,76 N2) –> CO2 + H20 + 3,76N2
Penyetaraan,
C4H10 + 13/2(O2 + 3,76 N2) –> 4CO2 + 5H2O + (13/2)*3,76N2
Reaksi juga bisa melibatkan bentuk tidak sempurna, misal memerlukan 200% udara.
C4H10 + 13(O2 + 3,76 N2) –> 4CO2 + 5H2O + (13/2)O2 + (13/2)*3,76N2
Pembakaran ini pun bisa melibatkan beberapa fraksi, karena elpiji biasanya tidak murni hanya bahan bakar butana.
Thermometer
Termometer merupakan alat yang digunakan untuk mengukur suhu.
Cara kerja thermometer:
Ketika temperature naik, cairan dibola tabung mengembang lebih banyak daripada gelas yang menutupinya. Hasilnya, benang cairan yang tipis dipaksa ke atas secara kapiler. Sebaliknya, ketika temperature turun, cairan mengerut dan cairan yang tipis ditabung bergerak kembali turun. Gerakan ujung cairan tipis yang dinamakan meniscus dibaca terhadap skala yang menunjukkan temperature.
Zat untuk thermometer haruslah zat cair dengan sifat termometrik artinya, mengalami perubahan fisis pada saat dipanaskan atau didinginkan, misalnya raksa dan alkohol. Zat cai tersebut memiliki dua titik tetap (fixed points), yaitu titik tertinggi dan titik terendah. Misalnya, titik didih air dan titik lebur es untuk suhu yang tidak terlalu tinggi. Setelah itu, pembagian dilakukan diantara kedua titik tetap menjadi bagian-bagian yang sama besar, misalnya thermometer skala celcius dengan 100 bagian yang setiap bagiannya sebesar 1C.
Pembakaran Batu Bara
Batubara banyak dimanfaatkan sebagai sumber bahan bakar, baik dirumah tangga maupun industri. PLTU menggunakan batubara untuk menggerakkan turbin sebagai sumber energi arus listrik. Selain itu, batubara juga dimanfaatkan untuk pembuatan kosmetik dan compac disk (CD). Kelemahan dari pembakaran batubara adalah dihasilkannya gas SO2. Untuk menghilangkan gas SO2 dapat diterapkan proses desulfurisasi. Proses ini menggunakan serbuk kapur (CaCO3) atau spray air kapur [Ca(OH)2] dalam alat scrubers. Reaksi yang terjadi:
CaCO3(s) + SO2(g) → CaSO3(s) + CO2(g)
Ca(OH)2(aq) + SO2(g) → CaSO3(s) + H2O( ?)
Namun, biaya operasional desulfurisasi dan pembuangan deposit padatan kembali menjadi masalah baru. Untuk meningkatkan nilai dari batubara dan menghilangkan pencemar SO2, dilakukan rekayasa batubara, seperti gasifikasi dan reaksi karbon-uap. Pada gasifikasi, molekul-molekul besar dalam batubara dipecah melalui pemanasan pada suhu tinggi (600°C – 800°C) sehingga dihasilkan bahan bakar berupa gas. Reaksinya adalah sebagai berikut.
Batubara(s) ® batubara cair (mudah menguap) ® CH4(g) + C(s)
Arang yang terbentuk direaksikan dengan uap air menghasilkan campuran gas CO dan H2, yang disebut gas sintetik. Reaksinya:
C(s) + H2O()® CO(g) + H2(g) ΔH = 175 kJ mol–1
Untuk meningkatkan nilai gas sintetik, gas CO diubah menjadi bahan bakar lain. Misalnya, gas CO direaksikan dengan uap air menjadi CO2 dan H2. Reaksinya:
CO(g) + H2O(g) ® CO2(g) + H2(g) ΔH = –41 kJ mol–1
Gas CO2 yang dihasilkan selanjutnya dipisahkan. Campuran gas CO
dan H2 yang telah diperkaya akan bereaksi membentuk metana dan uap
air. Reaksinya:
CO(g) + 3H2(g) ® CH4(g) + H2O(g) ΔH = –206 kJ mol–1
Setelah H2O diuapkan, akan diperoleh CH4 yang disebut gas alam sintetik. Dengan demikian, batubara dapat diubah menjadi metana melalui proses pemisahan batubara cair
Sistem dan Lingkungan Termokimia
Segala sesuatu yang menjadi pusat perhatian dalam mempelajari suatu perubahan energi dan berubah selama proses itu berlangsung disebut dengan sistem. Sedangkan hal-hal yang tidak berubah selama proses berlangsung dan yang membatasi sistem dan juga bisa mempengaruhi sistem disebut dengan lingkungan.
Berdasarkan interaksinya dengan lingkungan, sistem dibagi menjadi tiga macam, yakni sebagai berikut :
1. Sistem Terbuka
Sistem terbuka yaitu suatu sistem yang memungkinkan terjadi suatu perpindahan energi dan zat (materi) antara lingkungan dengan sistem. Pertukaran materi artinya ada suatu reaksi yang bisa meninggalkan wadah reaksi, misalnya gas.
2. Sistem tertutup
Suatu sistem yang mana antara sistem dan lingkungan bisa terjadi suatu perpindahan energi, tapi tidak terjadi pertukaran materi.
3. Sistem terisolasi
Sistem teriolasi yaitu Suatu sistem yang memungkinkan terjadinya perpindahan energi dan materi antara sistem dengan lingkungan.
Reaksi Termokimia
Reaksi pada termokimia terbagi atas reaksi eksoterm dan reaksi endoterm yaitu sebagai berikut:
1. Reaksi Eksoterm
Reaksi yang terjadi saat berlangsungnya pelepasan panas atau kalor. Reaksi panas ditulis dengan tanda negatif.
Contoh : N2 (g) + 3H2 (g) 2NH3 (g) – 26,78 Kkal
Perubahan entalpi pada reaksi ini digambarkan sebagai berikut:
Menurut hukum kekekalan energi :
2. Reaksi Endoterm
Reaksi yang terjadi ketika berlangsungnya penyerapan panas atau kalor, maka suatu perubahan entalpi reaksi bernilai positif.
Contoh : 2NH3 N2 (g) + 3H2 (g) + 26,78 Kkal
Perubahan entalpi pada reaksi endoterm dirumuskan yaitu sebagai berikut:
Kesimpulan :
Besarnya perubahan entalpi (ΔH) sama dengan besarnya panas reaksi, tapi dengan tanda berlawanan.
Jenis Perubahan Entalpi
1. Perubahan Entalpi Pembentukan (ΔHf)
Merupakan suatu perubahan entalpi pembentukan 1 mol senyawa dari unsur-unsur penyusunnya pada keadaan standar.
Nilai entalpi pembentukan standar ditentukan memakai tabel data entalpi pembentukan standar.
Nilai entalpi pembentukan standar:
- Bernilai positif, bila menerima energi
- Bernilai negatif, bila melepas energi
- Bernilai nol, bila unsur tersebut sudah terdapat di alam secara alami
- Bentuk unsur yang sudah di alam terbagi atas monoatomik dan poliatomik. Poliatomik berarti unsur pembentuknya lebih dari 1 unsur.
Contoh monoatomik : C(s), Fe(s), H+(aq), Ba(s), Ca(s), Mg(s), Na(s), Al(s), B(s), Zn(s), P(s). Monoatomik termasuk golonga gas mulia dan logam lainnya.
Contoh poliatomik : O2(g), Cl2(g), P4(s), H2(g), Br2(l), N2(g), I2(g), F2(g). Poliatomiktermasuk halogaen dan gas selain gas mulia.
Semua unsur-unsur yang sudah terdapat dialam ini nilai entalpi pembentukannya nol.
Misal:
2. Perubahan entalpi penguraian (ΔHd)
yaitu ΔH untuk menguraikan 1 mol suatu senyawa menjadi unsur-unsur penyusunnya pada keadaan standar.
Nilai entalpi penguraian standar berlawanan dengan nilai entalpi pembentukan standar. Pada reaksi penguraian reaktan berpindah ke kanan dan produk berpindah ke kiri.
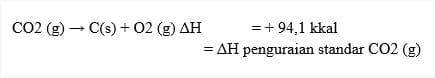
3. Perubahan entalpi pembakaran (ΔHc)
yaitu ΔH dalam pembakaran sempurna 1 mol suatu senyawa pada keadaan standar.
Nilai entalpi pembakaran standar ditentukan menggunakan tabel data entalpi pembakaran standar
Ciri utama dari reaksi pembakaran yaitu sebaagi berikut :
- Merupakan reaksi eksoterm
- Melibatkan oksigen dalam reaksinya
- Karbon terbakan menjadi CO2, hidrogen terbakar menjadi H2O, dan belerang terbakar menjadi SO2.
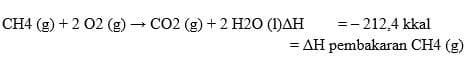
4. Perubahan entalpi netralisasi (ΔHn)
Termasuk reaksi eksoterm. yaitu suatu kalor yang dilepas pada pembentukan 1 mol air dan reaksi asam-basa pada suhu 25 derjat celsius dan tekanan 1 atmosfer.
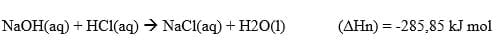
Penentuan Entalpi Reaksi
Penentuan ini dilakukan dengan:
- Menggunakan kalorimetri
- Menggunakan hukum Hess atau hukum penjumlahan
- Menggunakan data tabel entalpi pembentukan
- Menggunakan data energi ikatan
1. Penentuan dengan kalorimetri
Kalorimetri yaitu cara penentuan energi kalor reaksi dengan kalorimeter. Kalorimeter yaitu suatu sistem terisolasi, sehingga semua energi yang dibutuhkan atau dibebaskan tetap berada dalam kalorimeter. Dengan mengukur perubahan suhu, kita bisa menentukan jumlah energi kalor reaksi berdasarkan rumus:
Keterangan :
Ql = energi kalor pada larutan (J)
m = massa zat (kg)
c = kalor jenis zat (J/kg°C)
C = kapasitas kalor (J/°C)
Δt = perubahan suhu (°C)
Karena kalorimeter adalah suatu sistem terisolasi, maka tidak ada energi yang terbuang ke lingkungan, sehingga jumlah energi kalor reaksi dan perubahan entalpi reaksi menjadi:
2. Penentuan dengan data energi ikatan
Energi ikatan (E) yaitu suatu energi yang dibutuhkan untuk memutuskan 1 mol ikatan kovalen dari suatu senyawa, setiap ikatan membutuhkan sebuah energi yang berbeda supaya bisa terputus.
Reaksi berlangsung dalam dua tahap:
- Pemutusan ikatan reaktan
- Pembentukan ikatan produk
Tentukan perubahan entalpi reaksi dari pembakaran CH2 dibawah ini:
CH2(g) + 3 /2O2(g) → CO2(g) + H2O(g) ΔH = ?
(H–C–H)+ 3 /2(O=O)→(O=C=O)+(H–O–H)
Hukum Terkait Termokimia
1. Hukum Laplace
Hukum ini dikemukakan oleh Marquis de Laplace (1749-1827), yang berbunyi :
“Jumlah kalor yang dilepaskan pada pembentukan suatu senyawa dari unsur-unsurnya sama dengan jumlah kalor yang diperlukan untuk menguraikan senyawa itu menjadi unsur-unsurnya”.
Contoh :
H2(g) + ½ O2(g) à H2O(l) ΔH = -68,3 kkal/mol
H2O(l) à H2(g) + ½ O2(g) ΔH = 68,3 kkal/mol
2. Hukum Hess
Hukum Hess
Pengukuran perubahan entalpi suatu reaksi kadangkala tidak dapat ditentukan langsung dengan kalorimeter, misalnya penentuan perubahan entalpi pembentukan standar (DHf o )CO. Reaksi pembakaran karbon tidak mungkin hanya menghasilkan gas CO saja tanpa disertai terbentuknya gas CO2. Jadi, bila dilakukan pengukuran perubahan entalpi dari reaksi tersebut; yang terukur tidak hanya reaksi pembentukan gas CO saja tetapi juga perubahan entalpi dari reaksi pembentukan gas CO2.
Untuk mengatasi hal tersebut, Henry Hess melakukan serangkaian percobaan dan menyimpulkan bahwa perubahan entalpi suatu reaksi merupakan fungsi keadaan.
Artinya : “ perubahan entalpi suatu reaksi hanya tergantung pada keadaan awal ( zat-zat pereaksi ) dan keadaan akhir ( zat-zat hasil reaksi ) dari suatu reaksi dan tidak tergantung pada jalannya reaksi.” Pernyataan ini disebut Hukum Hess, rumus yang dapat dipakai yaitu :
ΔHreaksi = ΔH1 + ΔH2 +…
Menurut hukum Hess, karena entalpi adalah fungsi keadaan, perubahan entalpi dari suatu reaksi kimia adalah sama, walaupun langkah-langkah yang digunakan untuk memperoleh produk berbeda. Dengan kata lain, hanya keadaan awal dan akhir yang berpengaruh terhadap perubahan entalpi, bukan langkah-langkah yang dilakukan untuk mencapainya.
Hal ini menyebabkan perubahan entalpi suatu reaksi dapat dihitung sekalipun tidak dapat diukur secara langsung. Caranya adalah dengan melakukan operasi aritmatika pada beberapa persamaan reaksi yang perubahan entalpinya diketahui. Persamaan-persamaan reaksi tersebut diatur sedemikian rupa sehingga penjumlahan semua persamaan akan menghasilkan reaksi yang kita inginkan. Jika suatu persamaan reaksi dikalikan (atau dibagi) dengan suatu angka, perubahan entalpinya juga harus dikali (dibagi).
Jika persamaan itu dibalik, maka tanda perubahan entalpi harus dibalik pula (yaitu menjadi -ΔH). Berdasarkan Hukum Hess, penentuan DH dapat dilakukan melalui 3 cara yaitu :
1) Perubahan entalpi ( DH ) suatu reaksi dihitung melalui penjumlahan dari perubahan entalpi beberapa reaksi yang berhubungan.
2) Perubahan entalpi ( DH ) suatu reaksi dihitung berdasarkan selisih entalpi pembentukan ( DHf o ) antara produk dan reaktan.
3) Perubahan entalpi ( DH ) suatu reaksi dihitung berdasarkan data energi ikatan.
Selain itu, dengan menggunakan hukum Hess, nilai ΔH juga dapat diketahui dengan pengurangan entalpi pembentukan produk-produk dikurangi entalpi pembentukan reaktan. Secara matematis untuk reaksi-reaksi lainnya secara umum.
Dengan mengetahui ΔHf (perubahan entalpi pembentukan) dari reaktan dan produknya, dapat diramalkan perubahan entalpi reaksi apapun, dengan rumus
ΔH=ΔHfP-ΔH fR
Perubahan entalpi suatu reaksi juga dapat diramalkan dari perubahan entalpi pembakaran reaktan dan produk, dengan rumus
ΔH=-ΔHcP+ΔHcR
Konsep dari hukum Hess juga dapat diperluas untuk menghitung perubahan fungsi keadaan lainnya, seperti entropi dan energi bebas. Kedua aplikasi ini amat berguna karena besaran-besaran tersebut sulit atau tidak bisa diukur secara langsung, sehingga perhitungan dengan hukum Hess digunakan sebagai salah satu cara menentukannya.
Untuk perubahan entropi:
- ΔSo = Σ(ΔSfoproduk) – Σ(ΔSforeaktan)
- ΔS = Σ(ΔSoproduk) – Σ(ΔSoreaktan).
Untuk perubahan energi bebas:
- ΔGo = Σ(ΔGfoproduk) – Σ(ΔGforeaktan)
- ΔG = Σ(ΔGoproduk) – Σ(ΔGoreaktan)
3. Hukum kekekalan energy
Dalam perubahan kimia atau fisika energi tidak dapat diciptakan atau dimusnahkan, energi hanya dapat diubah dari satu bentuk ke bentu lainnya. Hukum ini merupakan hukum termodinamika pertama dan menjadi dasar pengembangan hukum tentang energi selanjutnya, seperti konversi energi.
Penentuan ΔH Reaksi
Hukum Hess menyatakan bahwa perubahan entalpi tidak tergantung pada berapa banyak tahapan reaksi, tetapi tergantung pada keadaan awal dan akhir. Dengan kata lain, untuk suatu reaksi keseluruhan tertentu, perubahan entalpi selalu sama, tak peduli apakah reaksi itu dilaksanakan secara langsung ataukah secara tak langsung dan lewat tahap-tahap yang berlainan.
Penentuan ∆H Reaksi berdasarkan Eksperimen (Kalorimeter)
Penentuan kalor reaksi secara kalorimetris merupakan penentuan yang didasarkan atau diukur dari perubahan suhu larutan dan kalorimeter dengan prinsip perpindahan kalor, yaitu jumlah kalor yang diberikan sama dengan jumlah kalor yang diserap. Kalorimeter adalah suatu sistem terisolasi (tidak ada pertukaran materi maupun energi dengan lingkungan di luar kalorimeter). Dengan demikian, semua kalor yang dibebaskan oleh reaksi yang terjadi dalam kalorimeter, kita dapat menentukan jumlah kalor yang diserap oleh air serta perangkat kalorimeter berdasarkan rumus:
q.larutan = m c ∆T
q.kalorimeter = C ∆T
dimana :
q = jumlah kalor
m = massa air (larutan) di dalam calorimeter
c = kalor jenis air (larutan) di dalam calorimeter
C = kapasitas kalor dari calorimeter
∆T = kenaikan suhu larutan (kalorimeter)
Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka kalor reaksi sama dengan kalor yang diserap oleh larutan dan kalorimeter, tetapi tandanya berbeda :
Kalorimeter yang sering digunakan adalah kalorimeter bom. Kalorimeter bom terdiri dari sebuah bom (wadah tempatberlangsungnya reaksi pembakaran, biasanya terbuat dari berlangsungnya reaksi pembakaran, biasanya terbuat dari bahan stainless steel) dan sejumlah air yang dibatasi dengan wadah kedap panas.
Jadi kalor reaksi sama dengan kalor yang diserap atau dilepaskan larutan, sedangkan kalor yang diserap atau dilepaskan larutan, sedangkan kalor yang diserap oleh gelas dan lingkungan diabaikan.
Penentuan ∆H Reaksi dengan Hukum Hess
Hukum Hess : ” Kalor reaksi yang dilepas atau diserap hanya bergantung pada keadaan awal dan keadaan akhir”. Untuk mengubah zat A menjadi zat B (produk) diperlukan kalor reaksi sebesar ∆H. Atau cara lain yaitu mengubah zat A menjadi zat B dengan kalor reaksi ∆H1, zat B diubah menjadi zat C dengan kalor reaksi ∆H2 dan zat C diubah menjadi zat D dengan kalor reaksi ∆H3 . Sehingga harga perubahan entalpi adalah :
∆Hreaksi = ∆H1 + ∆H2 + ∆H3 .
Hal tersebut dapat dibuat siklus dan diagram tingkat energinya sebagai
berikut :
- Siklus energi pembentukan zat D dari zat A
- Diagram tingkat energi pembentukan zat D dari zat A
Contoh Soal :
Diketahui data entalpi reaksi sebagai berikut :
Ca(s) + ½ O2(g) → CaO(s) ∆H = – 635,5 kJ
C(s) + O2(g) → CO2(g) ∆H = – 393,5 kJ
Ca(s) + C(s) + ½ O2(g) → CaCO3(g) ∆H = – 1207,1 kJ
Hitunglah perubahan entalpi reaksi : CaO(s) + CO2(g) → CaCO3(s) !
Penyelesaian :
CaO(s) ………………………..→ Ca(s) + ½ O2(g) ….∆H = + 635,5 kJ
CO2(g)………………………. → C(s) + O2(g) …………∆H = + 393,5 kJ
Ca(s) + C(s) + ½ O2(g) → CaCO3(s)…………….. ∆H = – 1207,1 kJ
_________________________________________ _
CaO(s) + CO2(g) ………..→ CaCO3(s)……………… ∆H = – 178,1 kJ
Penentuan ∆H Reaksi Berdasarkan Data Perubahan Entalpi
Pembentukan Standar ( ∆Hof )
Cara lain perhitungan entalpi reaksi yaitu berdasarkan entalpi pembentukan standar( ∆Hof ) zat-zat yang ada pada reaksi tersebut.
∆Hreaksi = ∑∆Hof produk – ∑∆Hof reaktan
TABEL ENTALPI PEMBENTUKAN BEBERAPA ZAT
| Zat | DHof ( kJ/mol ) | Zat | DHof ( kJ/mol ) |
| H2(g) | 0 | C2H4(g) | + 52,5 |
| O2(g) | 0 | CCl4(g) | – 96,0 |
| C(s) | 0 | NH3(g) | – 45,9 |
| H2O(g) | – 241,8 | NO2(g) | + 33,2 |
| H2O(l) | – 285,8 | SO2(g) | – 296,8 |
| CO2(g) | – 393,5 | HCl(g) | – 92,3 |
| CO(g) | -110,5 | NO(g) | + 90,3 |
Contoh Soal :
Dari tabel entalpi pembentukan diatas, tentukan :
- ∆H reaksi pembakaran C2H4 !
- Tentukan jumlah kalor yang dibebaskan pada pembakaran 56 g gas C2H4
- Reaksi pembakaran C2H4
- C2H4(g) + 3 O2(g)→2CO2(g) + 2H2O(l)
- ∆H reaksi = ∆Hof hasil reaksi – ∆Hof pereaksi
= ( 2. ∆Hof CO2 + 2. .∆Hof H2O ) – ( 1. ∆HofC2H4 + 3. ∆Hof O2)
= ( 2 . -393,5 + 2. -285,8 ) – ( 1. 52,5 + 3. 0 )
= -787 – 571,6 + 52,5
= – 1306,1 kJ/mol
- Mr C2H4 = (2×12) + (4×1) = 28
Mol C2H4 = 56/28 = 2 mol
∆H pembakaran 2 mol C2H4 = 2 mol x ( -1306,1 kJ/mol )
= -2612,2 kJ
Jadi pada pembakaran 56 gram gas C2H4 dibebaskan kalor sebesar = 2612,2 Kj
Penentuan ∆H Reaksi Dari Energi Ikatan
Reaksi kimia antarmolekul dapat dianggap berlangsung dalam 2 tahap yaitu :
- Pemutusan ikatan pada pereaksi
- Pembentukan ikatan pada produk
Misalnya, pada reaksi antara gas klorin dengan gas hidrogen membentuk gas hidrogen klorida dapat digambarkan sebagai berikut :
Sesuai dengan hukum Hess, ∆H reaksi total adalah ∆H tahap-I + ∆H tahap-II.
∆H tahap-I = ∑ Energi ikatan pada pereaksi (yang putus)
∆H tahap-II = -∑ Energi ikatan pada produk (yang terbentuk).
∆H reaksi = ∑ Energi ikatan pereaksi yang putus – ∑ Energi ikatan produk yang terbentuk
∆H reaksi = ∑ Eruas kiri – ∑ Eruas kanan
TABEL ENERGI IKATAN
| Ikatan | E (kJ/mol) | Ikatan | E (kJ/mol) |
| H-H | 436 | O=O | 498 |
| H-C | 415 | C≡N | 891 |
| H-N | 390 | F-F | 160 |
| C-C | 345 | Cl-Cl | 243 |
| C≡C | 837 | H-Cl | 432 |
| C-O | 350 | C=C | 611 |
| C=O | 741 | I-I | 150 |
| C-Cl | 330 | N=N | 418 |
| O-H | 450 | C-F | 485 |
Penyelesaian :
H – C – O-H +1 ½ O=O → O=C=O +2H-O-H
∆H reaksi = ∑Epemutusan -∑Epembentukan
= { (3.Ec-H)+( 1.EO-H) +(1.EC-O)+ (1 ½ EO=O)} – {(2.EC=O) + (4.EO-H)}
= {(3.415)+(1.460)+(1.350)+1 ½.498)} –{(2.741)+(4.460)}
= 2802-3322
= -520 kJ/mol
Energi Ikatan
Energi ikatan didefinisikan sebagai panas reaksi yang dihubungkan dengan pemecahan ikatan kimia dari molekul gas menjadi bagian-bagian gas. Terkadang disebut juga entalpi ikatan, nama yang sesungguhnya lebih tepat.
Energi disosiasi ikatan (B,E) dapat digunakan untuk menghitung panas reaksi yang dihubungkan dengan
ΔH0= – ∑ ni BEi + ∑ njBEj
dimana BE adalah energi ikatan per mol ikatan, nj dan ni adalah jumlah mol ikatan yang pecah atau terbentuk dalam hal reaktan dan produk.
Dalam hal yang sama, data panas reaksi dapat juga digunakan untuk menghitung energi disosiasi ikatan dari setiap ikatan tertentu, asal saja data lain dalam persamaan diketahui. Satu hal yang harus diingat bahwa lingkungan sekeliling atom sangat mempengaruhi energy ikatan dari ikatan tertentu; oleh karena itu harga yang diperoleh dari persamaan adalah harga rata-rata atau harga kira-kira.
Walaupun energi ikatan adalah untuk molekul dalam fase gas, tetapi harga kira-kira panas reaksi dapat dihitung dari fase terkondensasi dapat dikoreksi jika panas penguapan, panas sublimasi dan lain-lain dapat diikutsertakan.
Suatu reaksi yang DH–nya ditentukan dengan menggunakan energi ikatan, maka atom-atom yang terlibat dalam reaksi harus berwujud gas.
Berdasarkan jenis dan letak atom terhadap atom-atom lain dalam molekulnya, dikenal 3 jenis energi ikatan yaitu :
- Energi Atomisasi.
Adalah energi yang diperlukan untuk memutuskan semua ikatan 1 mol molekul menjadi atom-atom bebas dalam keadaan gas.
Energi atomisasi = jumlah seluruh ikatan atom-atom dalam 1 mol senyawa.
- Energi Disosiasi Ikatan.
Adalah energi yang diperlukan untuk memutuskan salah 1 ikatan yang terdapat pada suatu molekul atau senyawa dalam keadaan gas.
- Energi Ikatan Rata-Rata.
Adalah energi rerata yang diperlukan untuk memutuskan ikatan atom-atom pada suatu senyawa ( notasinya = D ). Energi ikatan suatu molekul yang berwujud gas dapat ditentukan dari data entalpi pembentukan standar (DHf ) dan energi ikat unsur-unsurnya. Prosesnya melalui 2 tahap yaitu :
o Penguraian senyawa menjadi unsur-unsurnya.
o Pengubahan unsur menjadi atom gas.
Reaksi kimia pada dasarnya terdiri dari 2 proses :
o Pemutusan ikatan pada pereaksi.
o Pembentukan ikatan pada produk reaksi.
Pada proses pemutusan ikatan = memerlukan energi.
Pada proses pembentukan ikatan = membebaskan energi
- Jenis-Jenis Kalor
Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Energi potensial berkaitan dengan wujud zat, volume, dan tekanan. Energi kinetik ditimbulkan karena atom–atom dan molekul-molekul dalam zat bergerak secara acak. Jumlah total dari semua bentuk energi itu disebut entalpi (H). Sedangkan kalor adalah bentuk energi yang berpindah dari suhu tinggi ke suhu rendah. Jika suatu benda menerima / melepaskan kalor maka suhu benda itu akan naik/turun atau wujud benda berubah.
- Kalor Pembentukan Standar
Adalah nama lain dari entalpi yang terjadi pada pembentukan 1 mol senyawa dariunsur-unsurnya pada suhu dan tekanan standar ( 25 oC, 1 atm ). Entalpinya bisadilepaskan maupun diserap. Satuannya adalah kJ / mol. Bentuk standar dari suatu unsur adalah bentuk yang paling stabil dari unsur itu pada keadaan standar ( 298 K, 1 atm ). Jika perubahan entalpi pembentukan tidak diukur pada keadaan standar maka dinotasikan dengan DHf.
Catatan :
o DHf unsur bebas = nol
o Dalam entalpi pembentukan, jumlah zat yang dihasilkan adalah 1 mol.
o Dibentuk dari unsur-unsurnya dalam bentuk standar.
- Kalor Penguraian Standar
Adalah nama lain dari entalpi yang terjadi pada penguraian 1 mol senyawa menjadi unsur-unsur penyusunnya pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHd. Satuannya = kJ / mol. Perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tanda.
Menurut Marquis de Laplace, “ jumlah kalor yang dilepaskan pada pembentukan senyawa dari unsur-unsur penyusunnya = jumlah kalor yang diperlukan pada penguraian senyawa tersebut menjadi unsur-unsur penyusunnya. “ Pernyataan ini disebut Hukum Laplace.
- Kalor Pembakaran Standar
Adalah nama lain dari entalpi yang terjadi pada pembakaran 1 mol suatu zat secara sempurna pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHc. Satuannya = kJ / mol.
- Kalor Netralisasi Standar
Adalah nama lain dari entalpi yang terjadi pada penetralan 1 mol asam oleh basa atau 1 mol basa oleh asam pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHn. Satuannya = kJ / mol.
- Kalor Penguapan Standar
Adalah nama lain dari entalpi yang terjadi pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHvap. Satuannya = kJ / mol.
- Kalor Peleburan Standar
Adalah nama lain dari entalpi yang terjadi pada pencairan / peleburan 1 mol zat dalam fase padat menjadi zat dalam fase cair pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHfus. Satuannya = kJ / mol.
- Kalor Sublimasi Standar
Adalah entalpi yang terjadi pada sublimasi 1 mol zat dalam fase padat menjadi zat dalam fase gas pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHsub. Satuannya = kJ / mol.
- Pelarutan Standar
Adalah nama lain dari entalpi yang terjadi ketika 1 mol zat melarut dalam suatu pelarut ( umumnya air ) pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHsol. Satuannya = kJ / mol.
Kesimpulan
Singkatnya, materi pembelajaran pada termokimia ini merupakan materi dasar yang wajib untuk dipelajari dan dipahami secara mendalam. Materi yang secara umum mencakup termodinamika I, kalor reaksi, kerja, entalpi, kalorimeter, hukum Hess, penentuan DH reaksi, energi ikatan, dan jenis-jenis kalor merupakan materi-materi dasar dalam pelajaran kimia yang berguna untuk mempelajari materi selanjutnya yang tentu saja lebih rumit. Dalam makalah ini materi duraikan secara singkat agar para pembaca lebih mudah memahaminya.
Berdasarkan pembahasan yang tinjauan pustaka yang kami susun dalam makalah ini, maka kami dapat menyimpulkan sebagai berikut :
- Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Energi potensial berkaitan dengan wujud zat, volume, dan tekanan.
- Berdasarkan perubahan entalpinya, reaksi kimia dibedakan menjadi dua yaitu,
- Reaksi Eksoterm dan,
- Reaksi Endoterm
- Sistem merupakan Pusat fokus perhatian yang diamati dalam suatu percobaan.Lingkungan merupakan hal-hal diluar sistem yang membatasi sistem dan dapat mempengaruhi sistem. Berdasarkan interaksinya dengan lingkungan, Sistem dibedakan menjadi 3 macam:
- Sistem Terbuka
- Sistem Tertutup
- Sistem terisolasi
- Dalam persamaan termokimia, nilai DH yang dituliskan di persamaan termokimia, disesuaikan dengan stoikiometri reaksinya, artinya = jumlah mol zat yang terlibat dalam reaksi kimia = koefisien reaksinya; ( fase reaktan maupun produk reaksinya harus dituliskan).
- Ada beberapa jenis dalam menentukan Harga Perubahan Entalpi ∆H , yaitu :
- Penentuan ∆H Reaksi Berdasarkan Data Perubahan Entalpi
- Penentuan ∆H Reaksi dengan Hukum Hess
- Penentuan kalor reaksi secara kalorimetris