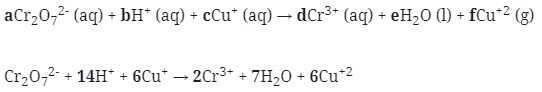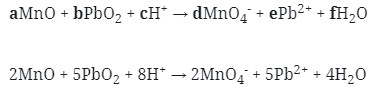1. Nilai bilangan okidasi dari Cr didalam K2CrO4 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Pembahasan :

Jawaban : C
2. Nilai bilangan okidasi dari S didalam Na2SO3 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Pembahasan :
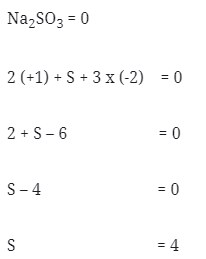
Jawaban : A
3. Nilai bilangan oksidasi dari Cl2 didalam Ca(ClO2)2 adalah . . .
a. 16
b. 6
c. 1
d. 4
e. 12
Pembahasan :

Jawaban : B
4. Reaksi Redoks :
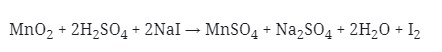
Yang berperan sebagai oksidator pada reaksi di atas adalah . . .
a. NaI
b. H2SO4
c. Mn2+
d. I–
e. MnO2
Pembahasan :
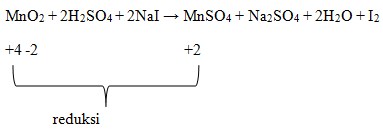
Diketahui bahwa oksidator yang mengalami reduksi atau penurunan biloks.
Dimana dilihat bahwa Mn pada MnO2 adalah +4.
Biloks Mn pad MnSO4 adalah +2.
Terjadi penurunan biloks, sehingga MnO2 menjadi oksidator.
Jawaban : E
5. Diketahui reaksi :
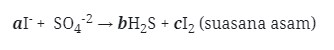
Jika reaksi diatas disetarakan makan koefisien a, b, dan c berturut-turut adalah . . .
a. 4, 1, 1
b. 4, 1, 2
c. 4, 1, 3
d. 4, 1, 4
e. 4, 1, 5
Pembahasan :
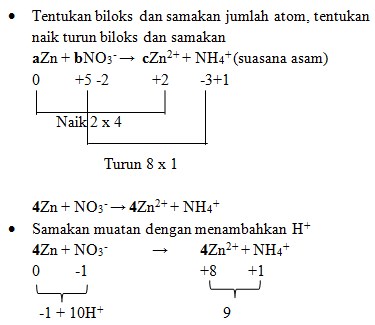
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+
- Samakan H dengan menambahkan H2O
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+ + 3H2O
Maka koefisiennya :
aZn + bNO3‾ → cZn²+ + NH4+
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+ + 3H2O
Jawaban : D
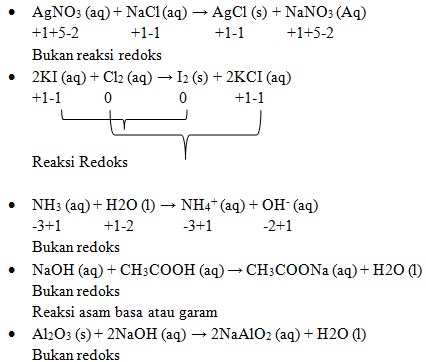
6. Diantara reaksi-reaksi dibawah ini yang merupakan reaksi redoks adalah . . .
a. AgNO3 (aq) + NaCl (aq) → AgCl (s) + NaNO3 (Aq)
b. 2KI (aq) + Cl2 (aq) → I2 (s) + 2KCI (aq)
c. NH3 (aq) + H2O (l) → NH4+ (aq) + OH– (aq)
d. NaOH (aq) + CH3COOH (aq) → CH3COONa (aq) + H2O (l)
e. Al2O3 (s) + 2NaOH (aq) → 2NaAlO2 (aq) + H2O (l)
Pembahasan :
Jawaban : B
7. Diketahui reaksi :
![]()
Jika reaksi tersebut disetarakan maka nilai koefisien a, b dan c adalah . . .
a. 8, 1, 2
b. 8, 2, 1
c. 16, 1, 8
d. 16, 2, 2
e. 8, 1, 1
Jawaban : C
Pembahasan :
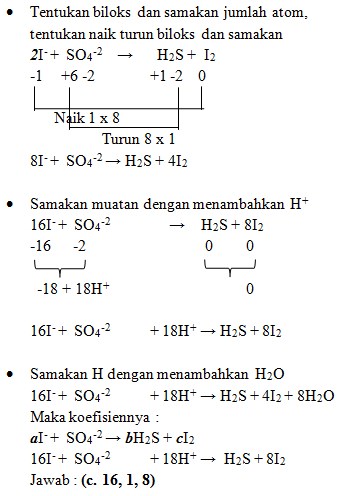
8. Diketahui reaksi :
![]()
Jika reaksi tersebut disetarakan maka nilai koefisien a, b dan c adalah . . .
a. 1, 1, 2
b. 1, 2, 1
c. 1, 1, 1
d. 1, 2, 2
e. 2, 1, 1
Jawaban : A
Pembahasan :
- Tulis secara terpisah persamaan setengah reaksinya (Oksidasi dan Reduksi)
Cl2 → Cl‾ (reduksi)
IO3‾ → IO4‾ (oksidasi)
Reduksi : Berkurangnya biloks
Oksidasi : Bertambah biloksnya
- Setarakan unsur yang mengalami perubahan biloks
Cl2 → 2Cl‾
IO3‾ → IO4‾
- Tambahkan H2O
- Jika reaksi berlangsung pada suasana asam tambahkan pada ruas yang kekurangan atom O
- Jika reaksi berlangsung pada suasana basa tambahkan pada ruas yang berlebihan atom O
Cl2 → 2Cl‾
IO3‾→ IO4‾ + H2O

9. Contoh reaksi oksidasi adalah . . .
a. Ag+ (aq) berubah menjadi Ag (s)
b. Cl2 (g) berubah menjadi Cl‾ (aq)
c. I– (aq) berubah menjadi I2 (s)
d. Cr6+ berubah menjadi CrO4¯²
e. H2O (l) berubah menjadi OH‾ (aq)
Pembahasan :
Oksidasi yaitu dimana bertambahnya bilangan oksidasi
Maka unsur di atas yang mengalami oksidasi adalah :
I‾ (aq) berubah menjadi I2 (s)
Dikarenakan I‾ = -1 menjadi I2 = 0
Sedangkan :
- Ag+ = +1 menjadi Ag = 0 reduksi
- Cl2 = 0 menjadi Cl‾¹ = -1 reduksi
- Cr+6 = +6 menjadi CrO4²‾ = 6 tidak terjadi reduksi maupun oksidasi
- H2O = +1 menjadi OH‾ = -1 reduksi
Jawaban : C
10. Reaksi Redoks berikut :
![]()
mempunyai nilai koefisien reaksi untuk a, b, c, dan d berturut-turut adalah . . . .
a. 1, 2, 4, 5
b. 1, 2, 2, 4
c. 1, 5, 4, 3
d. 1, 4, 1, 4
e. 1, 1, 1, 1
Pembahasan :
Untuk penyetaraan reaksi dapat menggunakan cara berikut :
Menggunakan metode ion elektron
- Tulis secara terpisah persamaan setengah reaksinya (Oksidasi dan Reduksi)
Cl2→ Cl‾ (reduksi)
SO2 → SO4‾² (oksidasi)
Reduksi : Berkurangnya biloks
Oksidasi : Bertambah biloksnya
- Setarakan unsur yang mengalami perubahan biloks
Cl2→ 2Cl‾
SO2 → SO4‾²
Tambahkan H2O
- Jika reaksi berlangsung pada suasana asam tambahkan pada ruas yang kekurangan atom O
- Jika reaksi berlangsung pada suasana basa tambahkan pada ruas yang berlebihan atom O
Karena reaksi berlangsung pada suasana asam maka H2O ditambahkan pada ruas yang kekurangan atom O
Jadi :
Cl2 → 2Cl‾
SO2 + 2H2O → SO4‾²
- Setarakan atom H dengan ion H+ pada suasana asam atau dengan ion OH– pada suasana basa
Maka :
SO2 + 2H2O → SO4‾² + 4H+
- Setarakan muatan pada kedua ruas dengan menambahkan elektron
Cl2 → 2Cl‾
0 -2
SO2 + 2H2O → SO42- + 4H+
0 0 -2 +4
- Jumlahkan kedua persamaan 1/2 reaksi tersebut dengan menyetarakan lebih dahulu jumlah elektronnya :
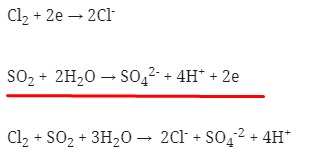
Maka koefesien berturut-turutnya untuk reaksi redoks tersebut adalah :
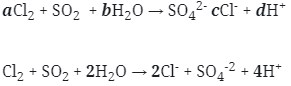
Jawaban : B
11. Reaksi Redoks berikut :
![]()
mempunyai harga koefisien reaksi untuk a, b, dan c berturut-turut adalah . . . .
a. 1, 2, 4
b. 2, 7, 6
c. 1, 2, 2
d. 1, 14, 2
e. 1, 14, 6
Pembahasan :
Untuk penyetaraan reaksi dapat menggunakan cara berikut :
Menggunakan metode ion elektron
- Tulis secara terpisah persamaan setengah reaksinya (Oksidasi dan Reduksi)
Cr2O7‾² → Cr3+ (Reduksi)
Cu+ → Cu²+ (oksidasi)
Reduksi : Berkurangnya biloks
Oksidasi : Bertambah biloksnya
- Setarakan unsur yang mengalami perubahan biloks
Cr2O7‾² → 2Cr3+
Cu+ → Cu+2
- Tambahkan H2O
- Jika reaksi berlangsung pada suasana asam tambahkan pada ruas yang kekurangan atom O
- Jika reaksi berlangsung pada suasana basa tambahkan pada ruas yang berlebihan atom O
Karena reaksi berlangsung pada suasana asam maka H2O ditambahkan pada ruas yang kekurangan atom O
Jadi :
Cr2O7‾² → 2Cr³+ + 7H2O
- Setarakan atom H dengan ion H+ pada suasana asam atau dengan ion OH‾ pada suasana basa
Maka :
Cr2O7‾² + 14H+ → 2Cr³+ + 7H2O
- Setarakan muatan pada kedua ruas dengan menambahkan elektron
Cr2O7‾² + 14H+ → 2Cr³+ + 7H2O
-2 +14 +6 0
- Jumlahkan kedua persamaan 1/2 reaksi tersebut dengan menyetarakan lebih dahulu jumlah elektronnya :

Maka koefesien berturut-turutnya untuk reaksi redoks tersebut adalah :
Jawaban : B
12. Reaksi Redoks berikut :
![]()
mempunyai harga koefisien reaksi untuk a, b, dan c berturut-turut adalah . . .
a. 2, 5, 8
b. 2, 6, 8
c. 2, 2, 7
d. 2, 6, 7
e. 2, 3, 8
Pembahasan :
Untuk penyetaraan reaksi dapat menggunakan cara berikut :
Menggunakan metode ion elektron
- Tulis secara terpisah persamaan setengah reaksinya (Oksidasi dan Reduksi)
MnO → MnO4‾ (Reduksi)
PbO2 → Pb+2 (oksidasi)
Reduksi : Berkurangnya biloks
Oksidasi : Bertambah biloksnya
- Setarakan unsur yang mengalami perubahan biloks
MnO → MnO4‾
PbO2 → Pb+2
- Tambahkan H2O
- Jika reaksi berlangsung pada suasana asam tambahkan pada ruas yang kekurangan atom O
- Jika reaksi berlangsung pada suasana basa tambahkan pada ruas yang berlebihan atom O
Karena reaksi berlangsung pada suasana asam maka H2O ditambahkan pada ruas yang kekurangan atom O
Jadi :
MnO + 3H2O → MnO4–
PbO2 → Pb2+ + 2H2O
- Setarakan atom H dengan ion H+ pada suasana asam atau dengan ion OH– pada suasana basa
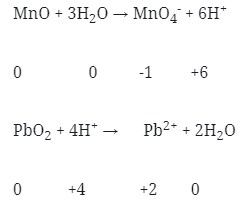
- Setarakan muatan pada kedua ruas dengan menambahkan elektron
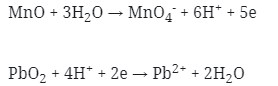
- Jumlahkan kedua persamaan 1/2 reaksi tersebut dengan menyetarakan lebih dahulu jumlah elektronnya :
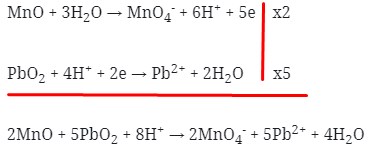
Maka koefesien berturut-turutnya untuk reaksi redoks tersebut adalah :
Jawaban : A
13. Diantara reaksi dibawah ini yang bukan merupakan reaksi redoks adalah . . .
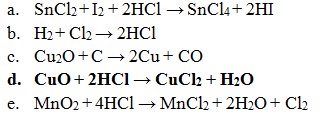
Pembahasan :
Reaksi Redoks yaitu dimana reaksi yang mengakibatkan ada unsur yang mengalami kenaikan biloks disebut teroksidasi dan yang terjdi penurunan disebut tereduksi.
Maka jika dilihat dari soal diatas :
- Reaksi redoks (Option A)
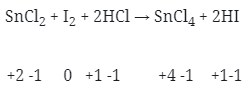
- Merupakan Reaksi redoks (Option B)
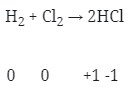
- Reaksi redoks (Option C)
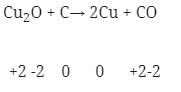
- Tidak terjadi reaksi redoks (Option D)
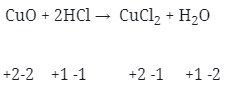
- Terjadi Reaksi redoks (Option E)
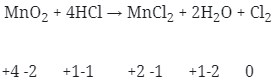
Jawaban : D
14. Reaksi Redoks berikut :
![]()
Mempunyai harga koefisien reaksi untuk a, b, d dan e berturut-turut adalah . . . .
a. 1, 3, 1, 6
b. 1, 3, 2, 6
c. 2, 3, 2, 6
d. 2, 3, 2, 3
e. 6, 2, 3, 1
Pembahasan :
Untuk penyetaraan reaksi dapat menggunakan cara berikut :
- Bagi reaksi menjadi 2 bagian
![]()
Pertama :
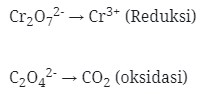
- Samakan jumlah atom
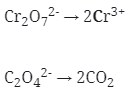
- Tambahkan H2O
![]()
- Setarakan atom H dengan ion H+ pada suasana asam atau dengan ion OH– pada suasana basa
![]()
- Setarakan muatan pada kedua ruas dengan menambahkan elektron, kemudan jumlah elektron dijumlahkan
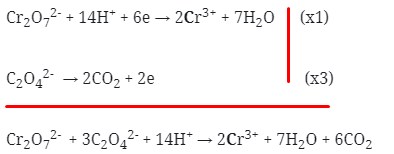
Maka koefesien berturut-turutnya untuk reaksi redoks tersebut adalah :
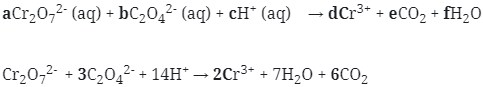
koefisien a, b, d, e berturut-turut adalah 1, 3, 2, 6
Jawaban : B
(Kumpulan soal persiapan UN 2014 Untuk SMA/MA, tim pemyusun)
15. Persamaan reaksi berikut :
![]()
Mempunyai harga a, b, c, d berturut-turut . . .
a. 14, 6, 2, 7
b. 6, 14, 2, 7
c. 6, 14, 1, 7
d. 2, 2, 5, 3
e. 3, 5, 1, 2
Pembahasan :

Jawaban : A
(Kumpulan soal persiapan UN 2014 Untuk SMA/MA, tim pemyusun)
16. Bilangan oksidasi fosfor paling rendah terdapat pada senyawa . . . .
a. PH4Br
b. POBr3
c. PF3
d. PCl5
e. Ca(PO4)2
Jawaban: A
Pembahasan:
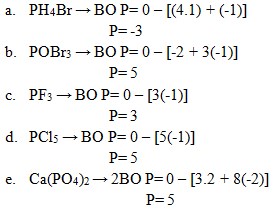
17. Bilangan oksidasi N = 2 terdapat pada senyawa . . . .
a. KNO3
b. N2O5
c. NO
d. N2O3
e. N2H4
Jawaban: C
Pembahasan:
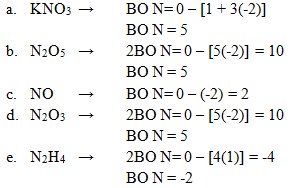
(Jalan Pintas Pintar Kimia:Sumarjo.ANDI.2010.hal 150)
18. Unsur yang dapat menunjukkan bilangan oksidasi paling positif dalam senyawa adalah . . . .
a. Oksigen
b. Belerang
c. Nitrogen
d. Klorin
e. Karbon
Jawaban: D
Penyelesaian:
Unsur non logam berlaku:
BO Maks = nomor golongan
BO Min = nomor golongan -8
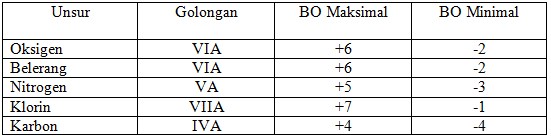
(Jalan Pintas Pintar Kimia:Sumarjo.ANDI.2010.hal 151)
19. Diantara persamaan reaksi redoks berikut ini yang benar adalah . . . .
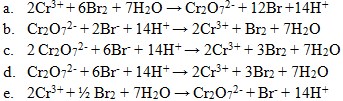
Jawaban: D
Pembahasan:
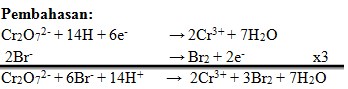
(Kimia Berbasis Eksperimen 3.Setot Budi Rahardjo.Platinum.hal 86)
20. Jika KMnO4 bereaksi dengan H2C2O4 dalam suasana asam maka sebagian hasilnya adalah MnSO4 dan CO2. Dalam reaksi ini 1 mol KMnO4 menerima . . . mol elektron.
a. 1
b. 2
c. 3
d. 5
e. 7
Jawaban: D
Penyelesaian:

(Jalan Pintas Pintar Kimia:Sumarjo.ANDI.2010.hal 155)
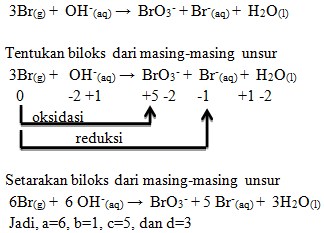
21. Reaksi berikut:
![]()
Harga koefisien a,b,c dan d supaya reaksi diatas setara adalah . . . .
a. 2,2,5, dan 1
b. 6,1,5, dan 3
c. 6,5,1, dan 3
d. 5,6,3, dan 1
e. 4,1,5, dan 2
Jawaban: B
Penyelesaian:
22. Yang termasuk reaksi autoredoks/disproporsionasi adalah . . . .
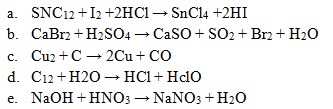
Jawaban: D
Penyelesaian:
Reaksi autoredoks adalah reaksi redoks dimana reduktor dan oksidasinya sama, yaitu:
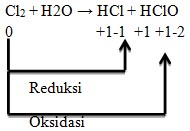
Cl mengalami reduksi dan oksidasi, sehingga bertindak sebagai reduktor maupun oksidator.
23. Banyaknya Fe+² yang dapat dioksidasi oleh 1 mol Cr2O7²‾ menjadi Fe+³ adalah . . . .
a. 2 mol
b. 4 mol
c. 5 mol
d. 6 mol
e. 7 mol
Jawaban: D
Penyelesaian:

(Kimia Berbasis Eksperimen 3.Setot Budi Rahardjo.Platinum.hal 86)
24. Reaksi redoks yang sudah mengalami penyetaraan ialah ….
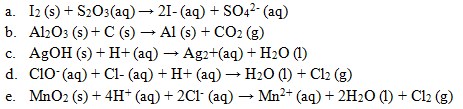
Jawaban: E
Penyelesaian:
![]()
Setara bila :
- Jumlah muatan kiri = muatan kanan
- Jumlah unsur sebelah kiri = jumlah unsur sebelah kanan.
25. Diantara reaksi-reaksi dibawah ini yang bukan merupakan reaksi redoks adalah . . . .
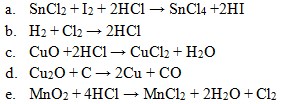
Jawaban: C
Pembahasan:
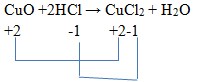
(tidak berubah)
Ciri dari reaksi redoks adalah ada perubahan bilangan oksidasi.
26. Pada reaksi redoks:
![]()
Harga koefisien a, b, c dan d berturut-turut adalah . . . .
a. 2, 1, 2, dan 2
b. 2, 1, 2, dan 4
c. 3, 2, 3, dan 4
d. 4, 1, 2, dan 3
e. 4, 1, 2, dan 4
Pembahasan:
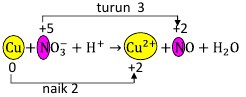
Terlihat pada Cu terjadi perubahan biloks sebesar 2, dan pada N sebesar 3.
Samakan banyaknya perubahan itu, kalikan masing-masing dengan bilangan pengali tertentu. Misal 3 akan kita kali 2, sementara 2 akan kita kali 3, jadi perubahannya sama yaitu 6.
Tempatkan bilangan pengali tadi di depan Cu dan N
Sehingga seperti ini
![]()
Berikutnya setarakan jumlah muatan kiri dan kanan. Di kanan muatannya 3 x (+2) = +6. Agar sama Tambahkan 8 di depan H+ sebelah kiri, sehingga muatan kiri = (−2) + 8 = +6 juga.
![]()
Terakhir samakan jumlah O.
![]()
Dengan menambah 4 di depan H2O jumlah O
kiri 2 x 3 = 6, dan O di kanan (2 + 4) = 6 juga.
Terlihat:
a = 3, b = 2, c = 3 dan d = 4.
Jawaban: C
(Kimia 3: Parning, Horale & Tiopan.Yudhistira.hal 77)
27. Jumlah elektron yang terlibat dalam reaksi berikut:
![]()
adalah . . . .
a. 15
b. 14
c. 13
d. 12
e. 11
Jawaban: A
Pembahasan:
![]()
Elektron yang terlibat adalah 15
28. Nilai bilangan oksidasi P dalam ion PO4³‾ adalah . . . .
a. +2
b. +3
c. +4
d. +5
e. +6
Jawaban: D
Pembahasan:
Ion PO4³‾ mempunyai bilangan oksidasi -3
-3 = (bilangan oksidasi P) + (4 × bilangan oksidasi O)
-3 = P + [4 × (-2)] → P = +5
Jadi, bilangan oksidasi P adalah +5
(Kimia 3: Parning, Horale & Tiopan.Yudhistira.hal 34)
29. Pada reaksi redoks
![]()
yang berperan sebagai oksidator adalah . . . .
a. NaI
b. H2SO4
c. Mn2+
d. I−
e. MnO2
Jawaban: E
Pembahasan:
Oksidator adalah yang mengalami reduksi atau penurunan biloks.
Dilihat biloks Mn pada MnO2 adalah +4, biloks Mn pada MnSO4 adalah + 2. Terjadi penurunan biloks, sehingga MnO2 menjadi oksidator.
(Kimia 3: Parning, Horale & Tiopan.Yudhistira.hal 36)
30. Bilangan oksidasi Br tertinggi terdapat pada senyawa . . . .
a. Fe(BrO2)3
b. Ca(BrO)2
c. HBrO4
d. AlBr3
e. PbBr4
Jawaban : C
Penyelesaian:

(Jalan Pintas Pintar Kimia:Sumarjo.ANDI.2010.hal 150)
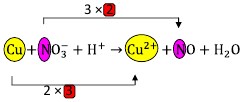
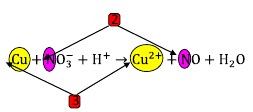
31. Perhatikan reaksi dibawah ini:
Penyelesaian:

Jawaban : A
(KIMIA untuk SMA kelas XII, Michael Purba, Erlangga, 2013, Hlm.45)
32. Pada reaksi redoks:
![]()
Setelah disetarakan, perbandingan koefisien reaksi Cr2O72- : Fe2+ adalah…..
a. 1 : 3
b. 1 : 4
c. 1 : 6
d. 2 : 3
e. 2 : 5
Penyelesaian:
Reaksi:
Cr2O72- (aq) + Fe2+ (aq) + H+ (aq) → H+ (aq) + Cr3+ (aq) + H2O (l) + Fe3+ (aq)
Disetarakan dengan cara setengah reaksi.
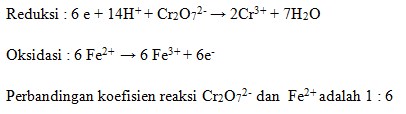
Jawaban: C
33. Pada persamaan reaksi redoks:
![]()
a dan b berturut-turut adalah…..
a. 2 dan 3
b. 2 dan 4
c. 2 dan 5
d. 3 dan 5
e. 4 dan 4
Penyelesaian:
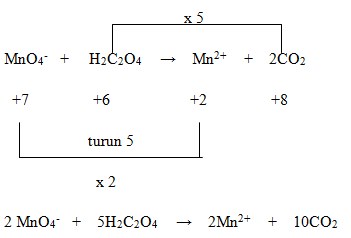
Jawaban : C
34. Gas klor dapat dibuat melalui reaksi redoks berikut:
![]()
Setelah disetarakan, nilai koefisien reaksi a, b, c dan d secara berurutan adalah…
a. 1, 2, 2, 7
b. 1, 2, 3, 7
c. 1, 2, 1, 7
d. 2, 1, 2, 7
e. 2, 2, 3, 7
Penyelesaian:

Jawaban : B
35. Diketahui persamaan reaksi redoks berikut:
![]()
Jika disetarakan, maka harga b, c dan d dari reaksi tersebut berturut-turut adalah…
a. 8, 2, dan 4
b. 8, 2, dan 3
c. 3, 8, dan 3
d. 3, 8, dan 2
e. 3, 2, dan 3
Penyelesaian:
- Cari perubahan biloks unsur Cr dan As
![]()
- Samakan perubahan biloks dengan menggunakan angka perkalian sebagai koefisien
![]()
- Samakan muatan dikiri dan kanan dengan penambahan H+ dan samakan jumlah O dengan penambahan H2O
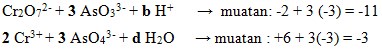
- Sehingga perlu penambahan 8 H+ dikiri dan 4 H2O dikanan
![]()
Jadi b = 8, c = 2, d = 4
Jawaban : A
36. Persamaan reaksi redoks:
![]()
Harga koefisien a, b, c dan d adalah….
a. 3, 6,5 dan 3
b. 3, 5, 6 dan 3
c. 3, 6, 5 dan 2
d. 3, 6, 5 dan 1
e. 3, 5, 6 dan 2
Penyelesaian:
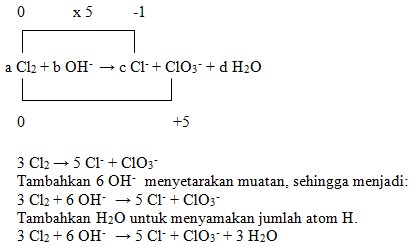
Jawaban : A
37. Perhatikan proses pembuatan iodine berikut:
![]()
Koefisien reaksi yang tepat untuk a, b dan c adalah….
a. 1, 1, dan 3
b. 1, 1, dan 5
c. 1, 3, dan 2
d. 2, 5, dan 3
e. 2, 5, dan 2
Penyelesaian:
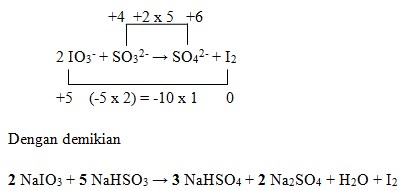
Jawaban : D
38. Proses pembuatan gas amoniak (NH3) dengan persamaan reaksi:
![]()
Zat yang bertindak sebagai oksidator adalah…
a. Al
b. NaNO3
c. NaOH
d. NaAlO2
e. NH3
Penyelesaian :
![]()
Oksidator merupakan zat yang mengalami reduksi, maka dalam reaksi diatas zat yang bertindak sebagai oksidator adalah NaNO3.
NO3‾ → NH3 (mengalami reduksi)
Jawaban: B
39. Pada reaksi berikut :
![]()
Zat yang mengalami reaksi disproporsionasi (autoredoks) berikut perubahan bilangan oksidasinya adalah…
a. Bromine dari -1 menjadi -2 dan 0
b. Bromine dari 0 menjadi -1 dan +1
c. Bromine dari 0 menjadi -2 dan +1
d. Natrium dari +1 menjadi -1 dan 0
e. Oksigen dari -2 menjadi -3 dan -1
Penyelesaian:
Autoredoks atau disproporsionasi adalah reaksi dimana melibatkan suatu zat yang mengalami reaksi oksidasi sekaligus reduksi.
Dari reaksi :
![]()
Yang mengalami reaksi disproporsionasi adalah bromine dari biloks 0 menjadi -1 dan +1
Jawaban: B
40. Diketahui beberapa persamaan reaksi berikut:
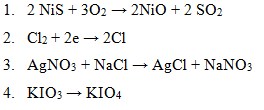
Reaksi oksidasi terdapat pada nomor….
a. 1 dan 2
b. 1 dan 4
c. 2 dan 3
d. 2 dan 4
e. 3 dan 4
Penyelesaian :
Reaksi reduksi:
- Reaksi yang melepas oksigen
- Yang mengikat elektron
- Reaksi yang mengalami penurunan bilangan oksidasi
- Bertindak sebagai oksidator
Reaksi oksidasi:
- Reaksi yang mengikat oksigen
- Yang melepaskan electron
- Reaksi yang mengalami kenaikan bilangan oksidasi
- Bertindak sebagai reduktor
Jadi, reaksi oksidasi terdapat pada nomor 1 ditandai dengan adanya pengikatan oksigen dan 4 ditandai dengan adanya kenaikan biloks dari +5 menjadi +7.
Jawaban : B
41. Perhatikan persamaan reaksi redoks yang terjadi pada proses pembuatan gas klorin dalam industry berikut:
![]()
Harga koefisien a, b dan c berturut-turut adalah…
a. 1, 1, dan 2
b. 1, 2, dan 1
c. 2, 1, dan 1
d. 2, 1, dan 2
e. 2, 2, dan 1
Penyelesaian:
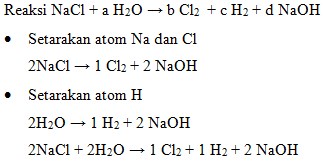
Harga koefisien a, b dan c adalah 2, 1, dan 1
Jawaban : C
42. Yang bukan merupakan reaksi redoks adalah…
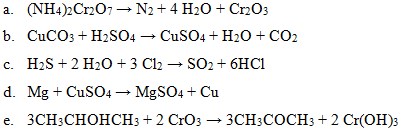
Penyelesaian:
Ada unsur bebas pasti : reaksi redoks
- Reaksi (a) ada unsure bebas N2
- Reaksi (b) tidak ada unsure bebas
- Reaksi (c) ada unsure bebas Cl2
- Reaksi (d) ada unsure bebas Cu
- Reaksi (e) tidak ada unsure bebas
Anda cukup cek jawaban B dan E, missal anda lihat pada pilihan E.
![]()
Biloks Cr berubah +6 menjadi +3
Jawaban : B
43. Reaksi MnO4‾ menjadi Mn2+ bila kuantitas KMnO4 semula adalah 0,1 mol maka elektron yang ditangkap oleh KMnO4 untuk menjadi ion Mn2+ sebanyak…
a. 5,0 mol
b. 2,5 mol
c. 1,0 mol
d. 0,5 mol
e. 0,7 mol
Penyelesaian:
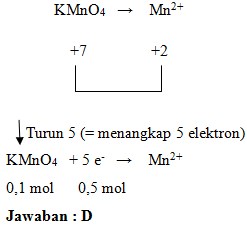
Jawaban : D
44. Banyaknya Fe2+ yang dapat dioksidasi oleh satu mol Cr2O7²‾ menghasilkan Fe2+ dan Cr3+ adalah….
a. 1 mol
b. 2 mol
c. 3 mol
d. 4 mol
e. 6 mol
Penyelesaian :
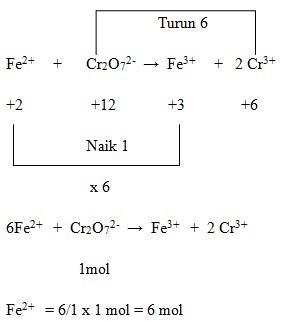
Jawaban : E
45. Diantara reaksi-reaksi dibawah ini termasuk redoks adalah…
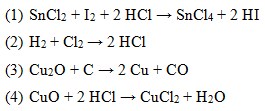
a. 1, 2, dan 3 benar
b. 1, 2 dan 4 benar
c. 1, 3 dan 4 benar
d. 1 dan 3
e. 1 dan 4
Penyelesaian :
Ada unsure bebas pasti : reaksi redoks
- Reaksi (1) ada unsur bebas I2
- Reaksi (2) ada unsur bebas H2 , Cl2
- Reaksi (3) ada unsur bebas C , Cu
- Reaksi (4) tidak ada unsur bebas
Jawaban : A