Fisika Kuantum – Menjelang akhir abad ke-19, banyak perkembangan yang terjadi pada dunia fisika. Setelah ditemukannya teori mekanika Newton, teori elektromagnetik Maxwell, dan termodinamika, fisika berhasil menjelaskan berbagai macam fenomena yang terjadi di dunia. Ketiga teori tersebut kemudian dikenal sebagai fisika klasik.
Seiring dengan berkembangnya berbagai peralatan untuk eksperimen, para fisikawan menemukan bahwa ada fenomena-fenomena yang tidak dapat dijelaskan menggunakan teori fisika klasik. Fenomena-fenomena ini baru dapat dijelaskan pada awal abad ke-20 yang merupakan awal era fisika modern. Era fisika modern sendiri ditandai dengan penemuan teori fisika yang mampu menjawab fenomena-fenomena yang sebelumnya tidak dapat dijelaskan oleh teori fisika klasik.
1. Fenomena Radiasi Benda Hitam
Kegagalan fisika klasik bermula di akhir abad ke-19 ketika para ilmuwan tidak mampu menjelaskan fenomena radiasi benda hitam. Meskipun tidak ada benda yang benar-benar hitam sempurna di dunia ini, secara teori benda hitam akan menyerap semua cahaya yang datang tanpa memancarkan radiasi energi berupa panas seperti benda-benda lainnya. Namun faktanya benda hitam tetap memancarkan radiasi energi dengan tingkatan atau intensitas yang berbeda. Intensitas ini dapat diprediksi dengan mengetahui temperaturnya menggunakan Hukum Rayleigh-Jeans.
Hukum Rayleigh-Jeans ditemukan oleh Lord Rayleigh dan Sir James Jeans, dua ilmuwan asal Inggris tahun 1900. Menurut hukum tersebut, semakin pendek suatu gelombang, seperti sinar ultraviolet, maka intensitas radiasi energinya semakin tinggi menuju tak hingga.
Sayangnya, hasil eksperimen menunjukkan bahwa semakin pendek gelombangnya, intensitas radiasinya justru menurun. Kegagalan Hukum Rayleigh-Jeans menjelaskan fenomena radiasi benda hitam ini dikenal sebagai Bencana Ultraviolet atau Ultraviolet Catastrophe.
2. Teori Kuantum
Pada tahun 1900, seorang fisikawan asal Jerman, Max Planck muncul dengan gebrakan baru yang menjadi awal munculnya fisika modern. Planck mampu menjelaskan permasalahan bencana ultraviolet yang sebelumnya tidak mampu dijelaskan oleh ilmuwan-ilmuwan lainnya.
Menurut Planck, radiasi elektromagnetik yang dipancarkan suatu benda terbagi-bagi, atau diskret ke dalam paket-paket energi yang disebut Kuantum. Besarnya energi ini bergantung pada besarnya frekuensi gelombang elektromagnetik. Planck menjelaskan teorinya ini dengan rumus matematik berikut.
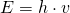
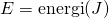
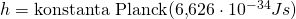
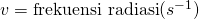
Teori Planck ini mampu menjelaskan bencana ultraviolet. Hasil perhitungan dengan persamaan Planck ini ternyata sama dengan hasil eksperimen sebelumnya. Mereka menunjukkan grafik pengamatan benda hitam dengan pola yang sama.
Atas penemuannya ini, Max Planck mendapatkan penghargaan Nobel Fisika pada tahun 1918. Teori Planck kemudian lebih dikenal sebagai Teori Kuantum dan mengawali peralihan fisika klasik menuju fisika modern. Teori Planck juga menginspirasi banyak ilmuwan terhadap berbagai pandangan baru, salah satunya mengenai cahaya.
3. Pemahaman Klasik Cahaya Sebagai Gelombang
Isaac Newton mengatakan bahwa cahaya terdiri atas partikel-partikel yang sangat kecil. Namun, berbagai eksperimen membuktikan bahwa cahaya juga merupakan sebuah gelombang. Salah satu eksperimen yang membuktikan bahwa cahaya merupakan gelombang adalah eksperimen celah ganda yang dilakukan oleh Thomas Young pada tahun 1801. Young menutup jendela di suatu ruangan gelap dan hanya membuka satu celah kecil yang menjadi sumber cahaya tunggal. Di depan cahaya tersebut diletakkan dua celah tipis yang berdekatan. Cahaya dari celah ganda tersebut kemudian diamati melalui sebuah layar.
Menurut teori Newton, hanya akan ada dua titik terang yang terlihat di layar karena partikel bergerak lurus melalui dua celah yang ada. Namun yang terbentuk di layar adalah pola gelap terang. Pola gelap terang ini muncul karena adanya fenomena interferensi yang dihasilkan oleh gelombang. Bagian gelap muncul ketika gelombang cahaya dari kedua celah saling meniadakan, dan bagian terang muncul ketika keduanya saling menguatkan. Berdasarkan percobaan tersebut, Young menyimpulkan bahwa cahaya adalah gelombang. Sayangnya, pemahaman klasik mengenai cahaya ini menemukan permasalahan ketika dihadapkan pada peristiwa efek fotolistrik.
4. Efek Fotolistrik
Peristiwa efek fotolistrik pertama kali diamati oleh fisikawan asal Jerman, Heinrich Hertz tahun 1887. Peristiwa ini berkaitan dengan suatu permukaan logam yang disinari oleh cahaya. Hasil dari penyinaran ini nantinya akan melepas elektron dari permukaan logam. Elektron yang lepas ini dapat diketahui karena muncul arus listrik. Munculnya arus listrik karena cahaya ini kemudian disebut sebagai efek fotolistrik.
Menurut Young, cahaya adalah gelombang yang mampu melepaskan elektron karena adanya transfer energi dari cahaya ke elektron. Energi elektron yang lepas dari permukaan logam akan dipengaruhi oleh intensitas cahaya, yakni seberapa terang cahaya tersebut menyinari permukaan logam. Semakin terang cahayanya, semakin besar energi elektronnya.
Namun kenyataannya, energi elektron yang lepas tidak dipengaruhi oleh intensitas cahaya. Sebanyak apapun cahaya yang disorot ke permukaan logam, tidak mempengaruhi energi elektron yang lepas, namun jumlah elektron yang lepas. Ketika permukaan logam disinari cahaya yang redup, jumlah elektron yang keluar akan sedikit. Sebaliknya, ketika permukaan logam disinari oleh cahaya yang terang, jumlah elektron yang keluar juga akan banyak. Namun, tingkat energi yang dikeluarkan akan tetap sama.
Tingkat energi akan berubah jika frekuensi cahaya berubah. Semakin besar frekuensi cahayanya, semakin besar pula energi elektron yang dihasilkan. Ini menunjukkan bahwa intensitas cahaya hanya berpengaruh pada jumlah elektron yang lepas, bukan energinya. Ini bertentangan dengan teori gelombang cahaya yang menyatakan bahwa intensitas cahaya berpengaruh pada jumlah energi elektron.
5. Pemahaman Cahaya Sebagai Artikel
Albert Einstein, seorang ahli fisika asal Jerman terinspirasi dengan pandangan Planck tentang radiasi gelombang elektromagnetik yang menjelaskan bahwa gelombang elektromagnetik terpaket-paket dalam energi yang disebut kuantum. Namun, Einstein lebih terfokus pada cahaya, salah satu gelombang elektromagnetik.
Einstein berpendapat bahwa sifat cahaya sebagai partikel berperan pada efek fotolistik. Einstein mengatakan bahwa cahaya adalah partikel yang memiliki massa dan momentum sehingga partikel bisa bertumbukan. Cahaya sebagai artikel ini dikenal dengan nama foton.
Pendapat Einstein ini menjawab pertanyaan mengapa intensitas cahaya hanya memengaruhi jumlah elektron yang lepas. Elektron-elektron yang lepas dari logam merupakan hasil tumbukan elektron dengan foton cahaya. Setelah saling bertumbukan, foton akan musnah karena menyerahkan energinya kepada elektron yang tertumbuk.
Sebagian energi yang diterima elektron akan digunakan oleh elektron untuk melepaskan diri dari permukaan logam, agar bisa lepas dari energi ambangnya. Energi ambang adalah energi batas yang dimiliki oleh logam untuk melepaskan elektronnya. Elektron baru bisa lepas dari permukaan logam apabila melewati energi ambangnya. Sisa energi dari foton tadi menjadi energi kinetik maksimal elektron setelah elektron bebas dari logam. Secara matematik dapat dituliskan melalui persamaan berikut.
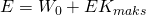
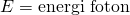
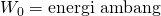

Atas jasanya dalam menjelaskan fenomena efek fotolistik, Albert Einstein kemudian mendapat penghargaan Nobel Fisika pada tahun 1921.
Dari penjabaran di atas, dapat disimpulkan bahwa selain sebagai gelombang, cahaya juga dapat berperilaku sebagai partikel. Dari simpulan tersebut, muncul gagasan Dualisme Gelombang Partikel di mana cahaya tidak hanya bisa bersifat sebagai gelombang namun dapat bersifat sebagai partikel pada situasi tertentu.
Rumus Minimal
Energi Foton
E = hf
E = h( c/λ )
Energi Foton Sejumlah n
E = nhf
E = nh( c/λ )
Konversi
1 elektron volt = 1 eV = 1,6 x 10−19 joule
1 angstrom = 1 Å = 10−10 meter
1 nanometer = 1 nm = 10−9 meter
Daya → Energi tiap sekon
Intensitas → Energi tiap sekon persatuan luas
Contoh Soal dan Pembahasan
Soal No. 1
Tentukan kuanta energi yang terkandung dalam sinar dengan panjang gelombang 6600 Å jika kecepatan cahaya adalah 3 x 108 m/s dan tetapan Planck adalah 6,6 x 10−34 Js !
Pembahasan
E = h(c/λ)
E = (6,6 x 10−34 )( 3 x 108/6600 x 10−10 ) = 3 x 10−19 joule
Soal No. 2
Panjang gelombang cahaya yang dipancarkan oleh lampu monokromatis 100 watt adalah 5,5.10−7 m. Cacah foton (partikel cahaya) per sekon yang dipancarkan sekitar....
A. 2,8 x 1022 /s
B. 2,0 x 1022 /s
C. 2,6 x 1020 /s
D. 2,8 x 1020 /s
E. 2,0 x 1020 /s
(Sumber soal : UM UGM 2004)
Pembahasan
Data :
P = 100 watt → Energi yang dipancarkan tiap sekon adalah 100 joule.
Energi 1 foton
E = h(c/λ)
E = (6,6 x 10−34 )( 3 x 108/5,5 x 10−7 ) joule
Jumlah foton (n)
n = 100 joule : [ (6,6 x 10−34 )( 3 x 108/5,5 x 10−7 ) joule] = 2,8 x 1020 foton.
Soal No. 3
Intensitas radiasi yang diterima pada dinding dari tungku pemanas ruangan adalah 66,3 W.m−2. Jika tungku ruangan dianggap benda hitam dan radiasi gelombang elektromagnetik pada panjang gelombang 600 nm, maka jumlah foton yang mengenai dinding persatuan luas persatuan waktu adalah ....(h = 6,63 x 10− 34 J.s, c = 3 x 108 m.s− 1)
A. 1 x 1019 foton
B. 2 x 1019 foton
C. 2 x 1020 foton
D. 5 x 1020 foton
E. 5 x 1021 foton
(Sumber soal : UN Fisika SMA 2010)
Pembahasan
Data :
I = 66,3 W.m−2 → Energi yang diterima tiap sekon tiap meter persegi adalah 66,3 joule.
Energi 1 foton
E = h(c/λ)
E = (6,63 x 10−34 )( 3 x 108/600 x 10−9 ) joule
Jumlah foton tiap sekon tiap satuan luas adalah:
n = 66,3 joule : [ (6,63 x 10−34 )( 3 x 108/600 x 10−9 ) joule] = 2 x 1020 foton
Soal No. 4
Tentukan perbandingan kuanta energi yang terkandung dalam sinar dengan panjang gelombang 6000 Å dan sinar dengan panjang gelombang 4000 Å !
Pembahasan
Data :
λ1 = 6000 Å
λ2 = 4000 Å
E = h(c/λ)
E1/E2 = λ2 : λ1 = 4000 : 6000 = 2 : 3
Soal No. 5
Energi foton sinar gamma adalah 108 eV. Jika h = 6,6 x 10−34 Js dan c = 3 x 108 m/s, tentukan panjang gelombang sinar gamma tersebut dalam satuan angstrom!
Pembahasan
Data :
E = 108 eV = 108 x (1,6 x 10−19) joule = 1,6 x 10−11 joule
h = 6,6 x 10−34 Js
c = 3 x 108 m/s
λ = ...?
λ = hc / E
λ = ( 6,6 x 10−34)(3 x 108) / (1,6 x 10−11)
λ = 12,375 x 10−15 meter =12,375 x 10−15 x 1010 Å = 12,375 x 10−5 Å
Soal No. 6
Bola lampu mempunyai spesifikasi 132 W/220 V, ketika dinyalakan pada sumber tegangan 110 V memancarkan cahaya dengan panjang gelombang 628 nm. Bila lampu meradiasikan secara seragam ke segala arah, maka jumlah foton yang tiba persatuan waktu persatuan luas di tempat yang berjarak 2,5 m dari lampu adalah ... (h =6,6.10−34 J s)
(A) 5,33 . 1018 foton.s m−2
(B) 4,33 . 1018 foton.s m−2
(C) 3,33 . 1018 foton.s m−2
(D) 2,33 . 1018 foton.s m−2
(E) 1,33 . 1018 foton.s m−2
(Sumber soal : SIMAK - UI 2009)
Pembahasan
Daya Lampu yang memiliki spesifikasi 132 W/220 V saat dipasang pada tegangan 110 V dayanya akan turun menjadi :
P2 =(V2/V1)2 x P1
P2 =(110/220)2 x 132 watt = 33 watt
Intensitas (daya persatuan luas) pada jarak 2,5 meter :
I = (P/A) dengan A adalah luas permukaan, anggap berbentuk bola (luas bola empat kali luas lingkaran).
I = (P/4π r2)
I = (33/4π (2,5)2) = 0,42 watt/m2
0,42 watt/m2 → Energi tiap sekon persatuan luas adalah 0,42 joule.
Jumlah foton (n) :
n = 0,42 : (hc/λ) = [ 0,42 ] : [ ( 6,6 x 10−34 )( 3 x 108 )/( 628 x 10−9 ) ] = ( 0,42 ) : (3,15 x 10−19 )
n = 1,33 x 1018 foton