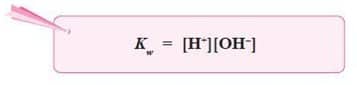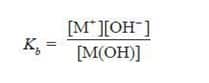Pengertian Asam, Basa, Dan Garam
Pengertian Asam, Basa, Garam, Ciri, Sifat, Indikator, Gambar dan Contoh : Asam adalah senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7. Basa adalah senyawa kimia yang menyerap ion hidronium ketika dilarutkan dalam air. Basa memiliki pH lebih besar dari 7. Garam atau “Natrium Klorida” (Nacl) adalah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion)
Pengertian Asam Basa dan Garam
Asam dan basa sudah dikenal sejak zaman dulu. Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti cuka. Istilah basa (alkali) berasal dari bahasa Arab yang berarti abu. Basa digunakan dalam pembuatan sabun. Juga sudah lama diketahui bahwa asam dan basa saling menetralkan. Di alam, asam ditemukan dalam buah-buahan, misalnya asam sitrat dalam buah jeruk berfungsi untuk memberi rasa limun yang tajam.
Cuka mengandung asam asetat, dan asam tanak dari kulit pohon digunakan untuk menyamak kulit. Asam mineral yang lebih kuat telah dibuat sejak abad pertengahan, salah satunya adalah aqua forti (asam nitrat) yang digunakan oleh para peneliti untuk memisahkan emas dan perak.
Pengertian Asam
Pengertian Asam adalah Asam dalam ilmu kimia ialah senyawa kimia yang jika dilarutkan dalam air akan menghasilkan sebuah larutan dengan pH lebih kecil dari 7. Dalam definisi modern, asam yaitu suatu zat yang bisa memberi proton (ion H+) kepada zat lain (yang disebut basa), atau bisa menerima pasangan elektron bebas dari suatu basa.
Pengertian Basa
Basa ialah zat(senyawa) yang bisa beraksi dengan asam, menghasilkan senyawa yang disebut garam. Sedangkan basa yaitu suatu zat-zat yang bisa menetralkan asam. Secara kimia, asam dan basa saling berlawanan. Sifat basa pada umumnya ditunjukkan dari rasa pahit dan licin.
Pengertian Garam
Dalam ilmu kimia, garam ialah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga akan membentuk senyawa netral (tanpa bermuatan). Garam terbentuk dari hasil sebuah reaksi asam dan basa.
Teori Asam dan basa Menurut Arrhenius
Pada tahun 1884, Svante Arrhenius (1859-1897) seorang ilmuwan Swedia yang memenangkan hadiah nobel atas karyanya di bidang ionisasi, memperkenalkan pemikiran tentang senyawa yang terpisah atau terurai menjadi bagian ion-ion dalam larutan. Dia menjelaskan bagaimana kekuatan asam dalam larutan aqua (air) tergantung pada konsentrai ion-ion hidrogen di dalamnya.
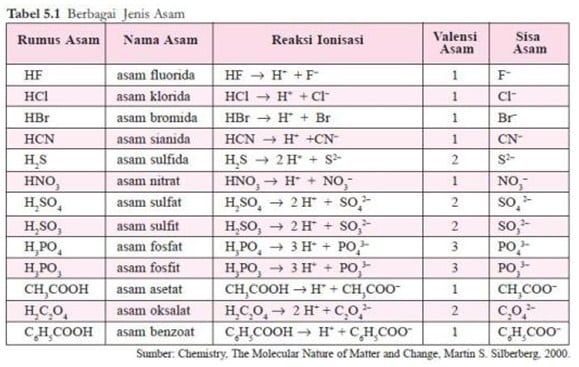
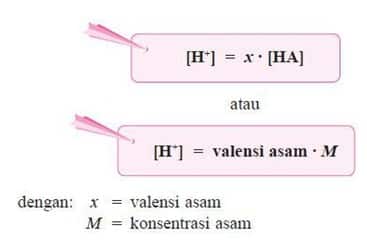
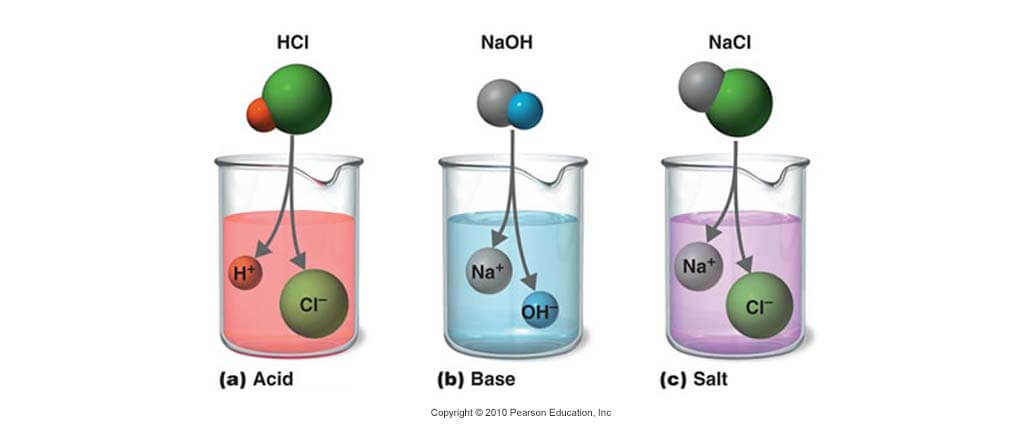
Menurut Arrhenius, asam adalah zat yang dalam air melepakan ion H+, sedangkan basa adalah zat yang dalam air melepaskan ion OH–. Jadi pembawa sifat asam adalah ion H+, sedangkan pembawa sifat basa adalah ion OH–. Asam Arrhenius dirumuskan sebagai HxZ, yang dalam air mengalami ionisasi sebagai berikut.
HxZ ⎯⎯→ x H+ + Zx–
Jumlah ion H+ yang dapat dihasilkan oleh 1 molekul asam disebut valensi asam, sedangkan ion negatif yang terbentuk dari asam setelah melepaskan ion H+ disebut ion sisa asam. Beberapa contoh asam dapat dilihat pada tabel
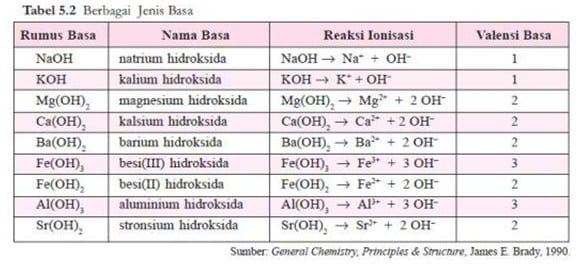
Basa Arrhenius adalah hidroksida logam, M(OH)x, yang dalam air terurai sebagai berikut.
M(OH)x ⎯⎯→ Mx+ + x OH–
Jumlah ion OH– yang dapat dilepaskan oleh satu molekul basa disebut valensi basa. Beberapa contoh basa diberikan pada tabel
H2SO4 ⎯⎯→ 2 H+ + SO42–
Mg(OH)2 ⎯⎯→ Mg+ + 2 OH–
- Persamaan ionisasi air dapat ditulis sebagai:
H2O(l) ←⎯⎯⎯⎯→ H+(aq) + OH–(aq)
- Harga tetapan air adalah:
- Konsentrasi H2O yang terionisasi menjadi H+ dan OH– sangat kecil dibandingkan dengan konsentrasi H2O mula-mula, sehingga konsentrasi H2O dapat dianggap tetap, maka harga K[H2O] juga tetap, yang disebut tetapan kesetimbangan air atau ditulisKw.
- Pada suhu 25 °C, Kw yang didapat dari percobaan adalah 1,0 × 10–14.
- Harga Kw ini tergantung pada suhu, tetapi untuk percobaan yang suhunya tidak terlalu menyimpang jauh dari 25 °C, harga Kw itu dapat dianggap tetap.
- Harga Kw pada berbagai suhu dapat dilihat pada tabel berikut.
Kekuatan Asam dan Basa
Kekuatan Asam
Kekuatan asam dipengaruhi oleh banyaknya ion – ion H+ yang dihasilkan oleh senyawa asam dalam larutannya. Berdasarkan banyak sedikitnya ion H+ yang dihasilkan, larutan asam dibedakan menjadi dua macam sebagai berikut.
Asam Kuat
Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi berkesudahan. Secara umum, ionisasi asam kuat dirumuskan sebagai berikut.
HA(aq) ⎯⎯→ H+(aq) + A–(aq)
Asam Lemah
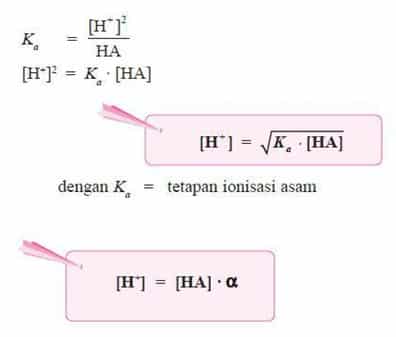
Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya. Reaksi ionisasi asam lemah merupakan reaksi kesetimbangan. Secara umum, ionisasi asam lemah valensi satu dapat dirumuskan sebagai berikut.
HA(aq) ←⎯⎯⎯⎯→ H+(aq) + A–(aq)
Makin kuat asam maka reaksi kesetimbangan asam makin condong ke kanan, akibatnya Ka bertambah besar. Oleh karena itu, harga Ka merupakan ukuran kekuatan asam, makin besar Ka makin kuat asam. Berdasarkan persamaan di atas, karena pada asam lemah [H+] = [A–], maka persamaan di atas dapat diubah menjadi:
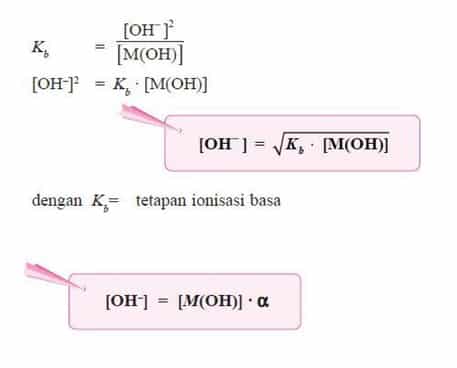
Kekuatan Basa
- Kekuatan basa dipengaruhi oleh banyaknya ion – ion OH– yang dihasilkan oleh senyawa basa dalam larutannya.
- Berdasarkan banyak sedikitnya ion OH yang dihasilkan, larutan basa juga dibedakan menjadi dua macam sebagai berikut.
Basa Kuat
- Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan.
- Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
M(OH)x(aq) ⎯⎯→ Mx+(aq) + x OH–(aq)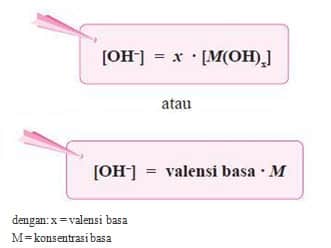
- Basa Lemah
- Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya.
- Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan.
- Secara umum, ionisasi basa lemah valensi satu dapat dirumuskan sebagai berikut.
M(OH)(aq) ←⎯⎯⎯⎯→ M+(aq) + OH–(aq)
- Makin kuat basa maka reaksi kesetimbangan basa makin condong ke kanan, akibatnya Kb bertambah besar.
- Oleh karena itu, harga Kb merupakan ukuran kekuatan basa, makin besar Kb makin kuat basa.
- Berdasarkan persamaan di atas, karena pada basa lemah [M+] = [OH–], maka persamaan di atas dapat diubah menjadi:

Derajat Keasamaan (pH)
Konsep pH
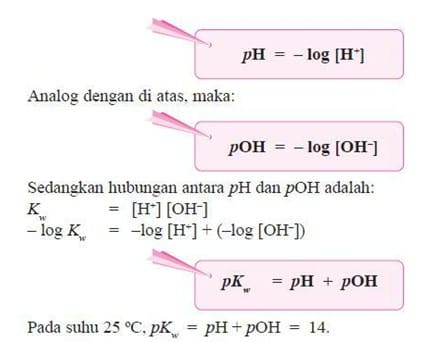
Untuk menyatakan tingkat atau derajat keasaman suatu larutan, pada tahun 1910, seorang ahli dari Denmark, Soren Lautiz Sorensen memperkenalkan suatu bilangan yang sederhana. Bilangan ini diperoleh dari hasil logaritma konsentrasi H+.
- Bilangan ini kita kenal dengan skala pH. Harga pH berkisar antara 1 – 14 dan ditulis:
- Dari uraian di atas dapat kita simpulkan bahwa:
Larutan bersifat netral jika [H+] = [OH–] atau pH = pOH = 7.
b. Larutan bersifat asam jika [H+] > [OH–] atau pH < 7.
c. Larutan bersifat basa jika [H+] < [OH–] atau pH > 7.
- Karena pH dan konsentrasi ion H+ dihubungkan dengan tanda negatif, maka makin besar konsentrasi ion H+ makin kecil pH, dan karena bilangan dasar logaritma adalah 10, maka larutan yang nilai pH-nya berbeda sebesar n mempunyai perbedaan ion H+ sebesar 10n.
- Perhatikan contoh di bawah ini.
- Jika konsentrasi ion H+ = 0,01 M, maka pH = – log 0,01 = 2
- Jika konsentrasi ion H+ = 0,001 M (10 kali lebih kecil) maka pH = – log 0,001 = 3 (naik 1 satuan)
- Jadi dapat disimpulkan:
- Makin besar konsentrasi ion H+ makin kecil pH
• Larutan dengan pH = 1 adalah 10 kali lebih asam dari pada larutan dengan pH = 2.
Pengukuran pH
Untuk menentukan pH suatu larutan dapat dilakukan dengan beberapa cara, antara lain sebagai berikut.
Menggunakan Beberapa Indikator
- Indikator adalah asam organik lemah atau basa organik lemah yang dapat berubah warna pada rentang harga pH tertentu (James E. Brady, 1990).
- Harga pH suatu larutan dapat diperkirakan dengan menggunakan trayek pH indikator.
- Indikator memiliki trayek perubahan warna yang berbeda-beda.
- Dengan demikian dari uji larutan dengan beberapa indikator akan diperoleh daerah irisan pH larutan.
- Contoh, suatu larutan dengan brom timol biru (6,0– 7,6) berwarna biru dan dengan fenolftalein (8,3–10,0) tidak berwarna, maka pH larutan itu adalah 7,6–8,3.
- Hal ini disebabkan jika brom timol biru berwarna biru, berarti pH larutan lebih besar dari 7,6 dan jika dengan fenolftalein tidak berwarna, berarti pH larutan kurang dari 8,3.
Ciri dan Sifat Asam, Basa dan Garam
Ciri-ciri Asam
Kata asam (acid) berasal dari bahasa Latin acidus yang berarti mempunyai rasa asam. Salah satu definisi asam adalah zat yang jika dilarutkan di dalam air akan menghasilkan ion hidrogen (H+). Secara umum asam memiliki ciri-ciri sebagai berikut:
- Rasa masam jika dicicipi (jangan menguji asam kuat dengan mencicipinya)
- Derajat keasaman lebih kecil dari 7 (pH < 7)
- Terasa menyengat jika disentuh, terutama asam kuat
- Reaksi dengan logam bersifat korosif (menyebabkan karat, dapat pula merusak jaringan kulit/iritasi dan melubangi benda yang terbuat dari kayu atau kertas jika konsentrasinya tinggi)
- Merupakan larutan elektrolit sehingga dapat menghantarkan arus listrik.
Sifat Asam
- Mempunyai rasa asam
- Mengubah lakmus biru menjadi merah
- Bersifat korosif, dapat melarutkan berbagai logam
- Dapat melarutkan batu kapur menghasilkan gas karbon dioksida.
Hujan Asam
Air hujan yang pH- nya kurang dari 5,6 disebut hujan asam.
Hujan asam terjadi karena udara tercemar oleh oksida-oksida yang bersifat asam khususnya oksida belerang (SO2) dan (SO3), oksida nitrogen (NO2) oksida belerang berasal dari bahan pembakaran fosil, dan oksida nitrogen berasal dari asap kendaraan bermontor dan asap industri.
Kerugian yang dapat ditumbulkan oleh hujan asam adalah :
- Merusak tumbuhan, karena hujan asam dapat mengubah pH tanah.
- Mengurangi kesuburan tanah, karena air hujan asam dapat membilas unsure hara dalam tanah.
- Mematikan biota air, karena air hujan asam dapat mengubah pH air
- Merusak bangunan, khususnya yang terbuat dari logam dan batu pualam.
Ciri-ciri Basa
Basa (alkali) berasal dari bahasa Arab yang berarti abu. Salah satu definisi basa adalah zat yang jika dilarutkan di dalam air akan menghasilkan ion hidroksida (OH–). Secara umum basa memiliki ciri-ciri sebagai berikut:
- Rasa pahit jika dicicipi
- Dalam keadaan murni umumnya berupa kristal padat
- Tingkat keasaman lebih besar dari 7 (pH > 7)
- Terasa licin di kulit (jangan menguji basa kuat dengan menyentuhnya)
- Memiliki sifat kaustik yaitu merusak kulit jika kadar basanya tinggi
- Dapat mengemulsi minyak
- Merupakan elektrolit, larutannya dapat menghantarkan arus listrik
Sifat Basa
Beberapa sifat basa sebagai berikut :
- Rasanya pahit
- Mengubah lakmus merah menjadi biru
- Bereaksi dengan lemak membentuk sabun.
- Menetralkan sifat asam
- Bersifat korosif, khususnya basa kuat.
Basa dalam kehidupan sehari-hari
- soda api (natrium hidroksida, NaOh), berfungsi untuk :
– Melarutkan lemak dan minyak
– membersihkan oven
– menghancurkan seloluse
- Kalsium hidroksida atau kapur (Ca(OH)
- Amonia ( larutan NH3) digunakan secagai pembersih kaca.
Indikator
Cara untuk mengetahui apakah suatu zat tergolong asam atau basa adalah menggunakan indikator.
Indikator adalah merupakan zat yang dapat berupah warna bila dimasukkan kedalam senyawa asam atau basa. Indikatar dapat berupa kertas atau larutan, indicator berupa kertas adalah kertas lakmus.
Ada dua macam kertas lakmus, yaitu lakmus berwarna merah dan lakmus berwarna biru. Cara pemakaiannya adalah kertas lakmus dimasukkan kedalam senyawa, kemudian dilihat perubahan warnanya.
Suatu senyawa tergolong asam bila kertas lakmus biru berubah warna menjadi merah, tetapi kertas lakmus merah tidak berubah warna.. sementara kalau senyawa golongan basa bila kertas lakmus merah berubah warna menjadi biru, tetapi kertas lakmus biru tidak berubah warna. Bila senyawa tidak mengubah warna kertas lakmus digolongkan bukan senyawa asam atau basa atau senyawa netral.
Ciri-ciri Garam
Apabila larutan asam dengan larutan basa direaksikan, maka ion H+ (dari asam) akan bereaksi dengan ion OH– (dari basa) membentuk air. Reaksi antara asam dan basa ini disebut reaksi penetralan (netralisasi) jika jumlah zat asam sama dengan jumlah zat basa. Disebut demikian karena selain air, dihasilkan pula suatu zat yang bersifat netral yaitu garam, jika jumlah asam dan jumlah basanya mempunyai perbandingan yang sama. Reaksi ini juga di kenal dengan reaksi penggaraman karena menghasilkan garam.
Garam terdapat dalam bentuk garam netral, garam basa dan garam asam. Umumnya garam mudah larut dalam air, merupakan padatan pada suhu kamar (25oC), merupakan elektrolit sehingga dapat menghantarkan arus listrik, memiliki titik didih dan titik leleh yang tinggi.
Sifat Garam
Garam dapat dibuat dengan mereaksikan suatu logam dengan asam kuat yang encer atau mereaksikan antara asam dengan basa., reaksi asam dengan basa disebut reaksi netralisasi.
Contoh reaksi netralisasi :
Asam klorida + natrium hidroksida Natrium klorida + air
Asam sulfat + Kalium klorida Kalsium sulfat + air
Asam nitrat + Lithium hidroksida Lithium nitrat + air
Asam klorida + Kalsium hidroksida Kalsium klorida + air
Reaksi netralisasi menghasilkan senyawa yang disebut garam. Contoh garam dapur (NaCL) yang terbentuk dari reaksi antara natrium hidroksida dengan asam klorida.
Contoh garam yang ada pada kehidupan kita sehari-hari :
- Natrium klorida (NaCL) yang disebut garam dapur
- Magnesium sulfat (MgSO4) yang disebut garam inggris sebagai abat pencuci perut.
- Kalsium karbonat (CaCO3) merupakan senyawa dalam batu kapur, marmer atau batu pualam.
- Natrium karbonat (Na2CO3) yang disebut soda pencuci
- Aluminium solfaf ( Al2(SO4) ), untuk penjernihan air
- Natrium stearat ( NaC17H35COO ), bahan sabun mandi
Indikator Asam, Basa dan Garam
Banyak sekali larutan di sekitar kita, baik yang bersifat asam, basa, maupun netral. Tahukah kamu bagaimana cara menentukan sifat asam dan basa larutan secara tepat? Indikator yang dapat digunakan adalah indikator asam basa.
Indikator adalah zat-zat yang menunjukkan indikasi berbeda dalam larutan asam, basa, dan garam. Cara menentukan senyawa bersifat asam, basa, atau netral dapat menggunakan kertas lakmus dan larutan indikator atau indikator alami.
Berikut adalah beberapa cara menguji sifat larutan.
- Indikator dengan Kertas Lakmus
Warna kertas lakmus dalam larutan asam, larutan basa dan larutan bersifat netral berbeda. Ada dua macam kertas lakmus, yaitu lakmus merah dan lakmus biru. Sifat dari masing-masing kertas lakmus tersebut adalah sebagai berikut.
a. Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
b. Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
c. Lakmus merah maupun biru dalam larutan netral tidak berubah warna.
Indikator Larutan Asam dan Basa Menggunakan Indikator Alami
Percobaan yang telah kamu lakukan adalah mengidentifikasi suatu larutan bersifat asam, basa atau netral dengan menggunakan kertas lakmus. Adakah cara lain untuk mengidentifikasi suatu larutan? Ada beberapa cara yang dapat kamu lakukan sendiri di rumah, yaitu dengan menggunakan indikator alami.
Berbagai bunga yang berwarna atau tumbuhan, seperti daun, mahkota bunga, kunyit, kulit manggis, dan kubis ungu dapat digunakan sebagai indikator asam basa. Ekstrak atau sari dari bahan-bahan ini dapat menunjukkan warna yang berbeda dalam larutan asam basa.
Sebagai contoh, ambillah kulit manggis, tumbuklah sampai halus dan campur dengan sedikit air. Warna kulit manggis adalah ungu (dalam keadaan netral). Jika ekstrak kulit manggis dibagi dua dan masing-masing diteteskan larutan asam dan basa, maka dalam larutan asam terjadi perubahan warna dari ungu menjadi cokelat kemerahan. Larutan basa yang diteteskan akan mengubah warna dari ungu menjadi biru kehitaman.
Contoh Asam, Basa dan Garam
Contoh Asam
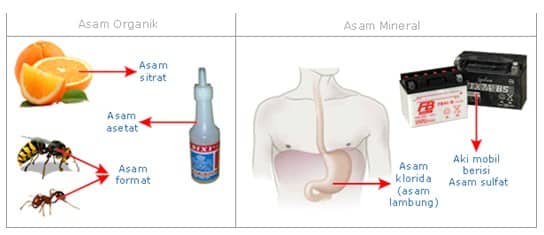
Asam dapat dengan mudah kita temui dalam kehidupan sehari-hari. Dalam makanan, minuman, buah-buahan, air hujan bahkan di dalam tubuh kita. Berdasarkan asalnya, asam dikelompokkan menjadi 2 kelompok, yaitu asam organik dan asam mineral.
Asam organik berasal dari sumber alami (tumbuhan dan hewan), umumnya bersifat asam lemah. Contoh asam organik adalah asam sitrat terdapat dalam buah jeruk, asam format terdapat dalam gigitan/sengatan semut dan sengatan lebah dan asam asetat yang terdapat dalam cuka makan. Asam mineral adalah senyawa asam seperti asam klorida (asam lambung) terdapat dalam sistem pencernaan manusia dan hewan.
Asam mineral banyak juga dimanfaatkan oleh manusia untuk memenuhi kebutuhan sehari-hari dan umumnya bersifat asam kuat. Contoh asam mineral adalah asam klorida yang digunakan secara luas dalam industri, asam sulfat untuk aki mobil dan asam fluorida yang biasanya digunakan pada pabrik kaca.
Berdasarkan kekuatannya asam dibagi menjadi dua jenis, yaitu asam kuat dan asam lemah. Kekuatan suatu asam dapat ditentukan dari kemampuannya melepaskan ion hidrogen yang bermuatan positif (ion H+) ketika dilarutkan dalam air. Semakin banyak ion H+ yang dilepaskan, semakin kuat sifat asamnya.
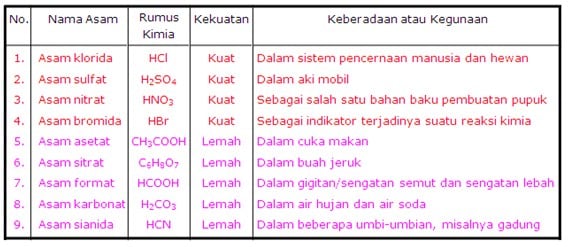
- Asam asetat, terdapat pada larutan cuka
- Asam askorbat, terdapat pada jeruk, tomat, sayuran
- Asam sitrat, terdapat pada jeruk
- Asam borat, terdapat pada larutan pencuci mata
- Asam karbonat, terdapat pada minuman berkarbonasi
- Asam klorida, terdapat pada asam lambung, obat tetes mata
- Asam nitrat, terdapat pada pupuk, bahan peledak (TNT)
- Asam fosfat, terdapat pada deterjent, pupuk
- Asam sulfat, terdapat pada baterai mobil, pupuk
- Asam tatrat, terdapat pada anggur
- Asam malat, terdapat pada apel
- Asam formiat, terdapat pada sengatan lebah
- Asam laktat, terdapat pada keju
- Asam benzoat, terdapat pada bahan pengawet makanan
Contoh Basa
Sama halnya dengan zat asam, zat basa juga dapat dengan mudah kita temui dalam kehidupan sehari-hari. Sifat licin dan rasanya yang pahit merupakan cara mudah untuk mengenali zat basa. Beberapa contoh zat basa yang sering digunakan adalah:
- Natrium hidroksida / soda api / soda ash dan kalium hidroksida, sebagai bahan baku pembersih dalam rumah tangga, misalnya sabun mandi, sabun cuci, detergen, pemutih dan pembersih lantai
- Magnesium hidroksida dan aluminium hidroksida, terkandung dalam obat nyeri lambung (antasid)
- Amoniak, untuk pelarut desinfektan (pencegah terjadinya infeksi) dan bahan baku pupuk urea
Sama seperti asam, basa juga dibedakan menjadi basa kuat dan basa lemah. Kekuatan suatu basa dapat ditentukan dari kemampuannya melepaskan ion hidroksida yang bermuatan negatif (ion OH–) ketika dilarutkan dalam air. Semakin banyak ion OH– yang dilepaskan, semakin kuat sifat basanya. Semua rumus kimia basa umumnya mengandung gugus OH–.
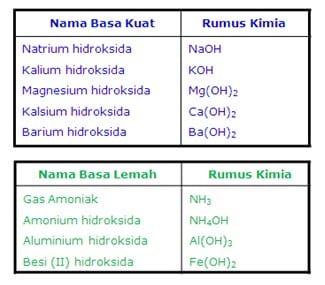
Jika diketahui rumus kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama logam dan diikuti kata hidroksida. Berikut ini tabel beberapa contoh basa kuat dan basa lemah:
- Aluminium hidroksida, terdapat pada sebuah deodoran, antasid
- Kalsium hidroksida, terdapat pada sebuah mortar dan plester
- Magnesium hidroksida, terdapat pada sebuah obat urus-urus, antasid
- Natrium hidroksida, terdapat pada sebuah bahan sabun mandi
Contoh Garam
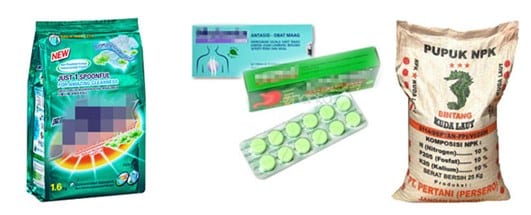
Salah satu cara memperoleh senyawa garam adalah dengan cara mereaksikan zat asam dengan zat basa. Reaksi ini dikenal dengan reaksi penggaraman atau disebut juga reaksi netralisasi. Dalam kehidupan sehari-hari garam yang sering digunakan antara lain: garam dapur (NaCl), garam inggris (MgSO4) sebagai obat pencahar, soda kue (NaHCO3) sebagai pengembang roti, monosodium glutamat (MSG) sebagai penyedap rasa.
Sifat garam tergantung pada asam dan basa pembentuknya. Garam yang berasal dari reaksi antara asam dan basa dapat bersifat asam, basa atau netral.
Garam yang bersifat asam, memiliki pH < 7, berasal dari reaksi antara asam kuat dan basa lemah. Contoh: NH4Cl (amonium klorida / salmoniak), dan NH4NO3 (amonium nitrat).
Garam yang bersifat basa, memiliki pH > 7, berasal dari reaksi antara asam lemah dan basa kuat. Contoh: KNO2 (kalium nitrit), NaHCO3 (natrium bikarbonat / soda kue), NaCH3COO (natrium asetat), KCN (kalium sianida / potas), dan KF (kalium fosfat).
Garam yang bersifat netral, memiliki pH = 7, berasal dari asam kuat dan basa kuat.
Contoh: NaCl (natrium klorida), KI (kalium iodida), dan KNO3 (kalium nitrat).
- garam dapur, NaCl → Na+ + Cl-
- besi sulfat, Fe2(SO4)3 → 2Fe3+ + 3SO3-4
Reaksi penggaraman (netralisasi) sangat berguna bagi kehidupan manusia. Dalam kehidupan sehari-hari banyak dijumpai pemanfaatan reaksi netralisasi, misalnya:
- Untuk mengurangi rasa sakit dan iritasi akibat sengatan lebah yang mengandung asam digunakan soda kue (natrium bikarbonat)
- Nyeri lambung akibat kadar asam klorida dalam lambung yang berlebihan dinetralisir dengan obat yang mengandung basa magnesium hidroksida atau aluminium hidroksida
- Limbah cair hasil industri yang dibuang ke sungai mengandung zat asam yang dapat menyebabkan kematian ikan oleh karenanya ditambahkan aluminium hidroksida untuk menetralkannya
- Mulut kita mengandung zat asam sisa makanan dan minuman yang dapat merusak gigi dan menimbulkan bau mulut, untuk menetralisirnya kita menggunakan pasta gigi yang mengandung zat basa
Tanah yang terlalu asam akibat hujan asam dan tanah gambut, dapat menyebabkan tanaman tidak dapat tumbuh dengan baik. Untuk mengatasinya tanah diberi senyawa yang bersifat basa, misalnya kalsium oksida, kalsium hidroksida atau kalsium karbonat sebelum ditanami.