1. Urutan unsur-unsur alkali tanah berdasarkan sifat reduktor dari kuat ke reduktor lemah adalah …
a. Ca, Mg, Sr, Ba
b. Mg, Ca, Ba, Sr
c. Mg, Ca, Sr, Ba
d. Ba, Sr, Ca, Mg
e. Ca, Ba, Mg, Sr
Jawaban : D
Pembahasan :
Sifat reduktor berarti sifat oksidasi. Maka dari bawah keatas ditabel periodik sifat reduktor semakin lemah
2. Pada elektrolisis larutan garam logam alkali atau alkali tanah tidak dihasilkan logamnya karena ….
a. sifat oksidatornya lemah
b. sifat reduktornya lemah
c. garam halidanya mempunyai titik leleh tinggi
d. energi ionisasi tinggi dari logam lain
e. ion logamnya tidak mengalami reduksi
Jawaban : E
Pembahasan
Pada elektrolisis larutan garam logam Alkali atau Alkali tanah tidak menghasilkan logam sebab :
- harga E° lebih kecil dari E° air
- ion logamnya tidak mengalami reduksi
3. Air yang mengandung garam CaSO4dapat dilunakkan dengan cara ….
a. dipanaskan
b. didestilasi
c. ditambah soda
d. ditambah kaporit
e. ditambah tawas
Jawaban : C
Pembahasan:

4. Bahan deterjen yang berfungsi mengikat ion Ca2+dan Mg2+ yang terdapat dalam air sadah adalah ….
a. Akil Benzena Sulfonat (ABS)
b. Sodium Lauryl Sulfonat (SLS)
c. Sodium Tripoly Phoshat ( STTP )
d. Carboksi Metil Cellulosa (CMC )
e. Natrium Silikat (Na2SiO3)
Jawaban : D
Pembahasan
Bahan tambahan yang dipakai untuk menambah daya guna deterjen adalah CMC (Karboksi metil selulosa) pakai agar kotoran yang telah dibawa oleh deterjen ke dalam larutan, tidak kembali lagi ke bahan cucian pada waktu mencuci pada waktu mencuci.
5. Logam alkali tanah jika beraksi dengan air menghasilkan gas H2 kecuali ….
a. Ca
b. Be
c. Sr
d. Ba
e. Mg
Jawaban : B
Pembahasan:
Ca, Sr, Ba bereaksi dengan air menghasilkan basa dan H2. Be tidak bereaksi dengan air sebab akan membentuk Be2O yang melapisi permukaan logam.
6. Kereaktifan logam alkali tanah dari bawah keatas adalah..
a. Semakin kecil ditunjukan dengan makin kecilnya harga energi ionisasi.
b. Semakin besar ditunjukan dengan makin kecilnya harga energi ionisasi.
c. Semakin kecil ditunjukan dengan makin besarnya harga energi ionisasi.
d. Semakin besar ditunjukan dengan makin besarnya harga energi ionisasi.
e. Semakin kecil ditunjukan dengan makin berkurangnya harga energi ionisasi.
Jawaban : C
Pembahasan : Kereaktifan logam-logam alkali tanah dari bawah keatas makin kecil karena makin kecilnya harga energi ionisasi. hal itu disebabkan kuatnya gaya tarik inti terhadap elektron terluar sehingga elektron terluar tersebut sulit untuk dilepaskan.
7. Basa alkali tanah yang paling sukar larut dalam air dan mempunyai sifat amfoter adalah …
a. Be(OH)2
b. Mg(OH)2
c. Ca(OH)2
d. Sr(OH)2
e. Ba(OH)2
Jawaban : A
Pembahasan
Dalam satu Golongan logam Alkali tanah makin mudah larut, artinya ion logam dan ion hidroksida mudah terurai. Hal ini menunjukkan sifat basanya makin kuat jadi Be(OH)2 termasuk sukar larut dalam air.
8. Senyawa hidroksida logam alkali tanah yang dalam bentuk suspensi digunakan sebagai obat sakit lambung adalah ….
a. Be(OH)2
b. Mg(OH)2
c. Ca(OH)2
d. Sr(OH)2
e. Ba(OH)2
Jawaban : B
Pembahasan:
Senyawa Mg(OH)2 adalah obat sakit perut (Antasida) yang dapat menetralkan kelebihan asam lambung (HCl).
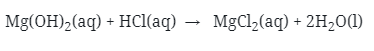
9. Urutan kelarutan garam sulfat alkali tanah yang benar adalah …
a. CaSO4 > MgSO4 > BaSO4 > SrSO4
b. MgSO4 > CaSO4 > SrSO4 > BaSO4
c. MgSO4 > SrSO4 > CaSO4 > BaSO4
d. SrSO4 > CaSO4 > BaSO4 > MgSO4
e. BaSO4 > SrSO4 > CaSO4 > MgSO4
Jawaban : B
Pembahasan
Kelarutan garam sulfat alkali tanah semakin ke bawah semakin sukar larut atau semakin ke atas semakin mudah larut, sehingga urutan kelarutannya garam sulfat Mg, Ca, Sr, Ba.
10. Urutan unsur-unsur alkali tanah berdasarkan sifat reduktor dari lemah ke reduktor kuat adalah …
a. Ca, Mg, Sr, Ba
b. Mg, Ca, Ba, Sr
c. Mg, Ca, Sr, Ba
d. Ca, Mg, Ba, Sr
e. Ca, Ba, Mg, Sr
Jawaban : C
Pembahasan :
Sifat reduktor berarti sifat oksidasi. Maka dari atas kebawah ditabel periodik sifat reduktor semakin kuat
11. Pernyataan yang tepat tentang cara memperoleh logam alkali adalah….
a. reduksi garam kloridanya
b. oksidasi garam kloridanya
c. elektrolisis leburan garam kloridanya
d. elektrolisis larutan garam kloridanya
e. hidrolisis larutan garam kloridanya
(Ebtanas 2001)
Jawaban: C
Pembahasan :
Logam alkali dapat diperoleh dengan mereduksi oksidanya atau dengan mengelektrolisis leburan garamnya (terutama garam kloridanya).
Sebagai contoh logam Na. sumber utama logam Na adalah garam batu dan air laut. Na hanya dapat diperoleh dari elektrolisis leburan NaCl menggunakan sel Down.
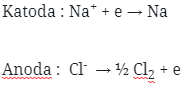
12. Pada natrium jika diberi oksigen berlebihan maka senyawa yang dihasilkan adalah….
a. NaO
b. Na2O2
c. Na2O
d. NaO2
e. 2Na2O
Jawaban: B
Pembahasan :
Jika oksigen berlebihan, natrium dapat membentuk peroksida dengan reaksi:
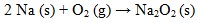
13. Pada elektrolisis larutan garam logam alkali tidak dihasilkan logamnya karena….
a. sifat oksidatornya lemah
b. sifat reduktornya lemah
c. garam halidanya mempunyai titik leleh tinggi
d. energi ionisasinya tinggi dari logam lain
e. ion logamnya tidak mengalami reduksi
Jawaban: E
Pembahasan:
Pada elektrolisis larutan garam logam alkali tidak menghasilkan logam sebab:
- Harga Eo lebih kecil dari Eo air (+1,28)
- Ion logamnya tidak mengalami reduksi
Logam-logam alkali sangat stabil terhadap pemanasan, sehingga logam-logam alkali tidak dapat diperoleh dari oksidanya melalui proses pemanasan. Logam alkali tidak dapat dihasilkan dengan mereduksi oksidasinya,
hal ini disebabkan logam-logam alkali merupakan pereduksi yang kuat. Jika di elektrolisis dengan larutan garam maka yang menempel adalah airnya bukan logamnya dan akan membentuk basa alkali bukan logam alkali. sehingga yang dapat dielektrolisis adalah leburan garamnya.
14. Elektrolisis garam-garam alkali berikut yang dapat menghasilkan logam alkali adalah….
a. larutan KI dengan elektroda C
b. larutan KI dengan elektroda Fe
c. larutan Na2SO4 elektroda C
d. lelehan NaCl electrode C
e. larutan NaI electrode C
Jawaban: D
Pembahasan
Elektrolisis logam alkali hanya dapat dengan lelehan garamnya, sehingga dari pilihan di atas dapat di buat dari lelehan NaCl.

15. Logam alkali lebih reaktif dibandingkan degan alkali tanah, karena….
a. Keelektronegatifan logam alkali lebih besar daripada logam alkali tanah
b. Energi ionisasi logam alkali leih besar daripada logam alkali tanah
c. Jari-jari atom logam alkali lebih besar daripada logam alkali tanah
d. Muatan inti logam alkali lebih besar daripada logam alkali tanah
e. Sifat logam alkali lebih besar daripada logam alkali tanah
Pembahasan :
Sifat kimia logam alkali bermiripan dengan logam alkali tanah, tetapi logam alkali lebih reaktif dibandingkan dengan logam alkali tanah. Hal ini disebabkan jari-jari atom logam alkali tanah lebih kecil, sehingga energi pengionan lebih besar.
Jawaban : C
16. Diantara sifat-sifat dibawah ini yang bukan sifat logam alkali adalah ….
a. Mudah bereaksi dengan air
b. Lunak, mudah diiris dengan pisau
c. Membentuk oksida basa
d. Putih mengkilap seperti perak
e. Terdapat di alam dalam keadaan bebas
Pembahasan :
Unsur alkali merupakan unsur logam yang lunak (mudah diiris dengan pisau). Pada saat permukaan saat logam dibersihkan terlihat warna logam putih mengkilap (seperti perak).
Logam alkali merupakan konduktor panas dan listrik yang baik. Disebut logam alkali karena oksidanya mudah larut dalam airdan menghasilkan larutan yang bersifat sangat basa. Semua logam alkali sangat reakstif sehingga di alam tidak pernah diperoleh dalam keadaan bebas.
Jawaban : E
17. Unsur-unsur logam alkali dengan urutan Li, Na, K, Rb, dan Cs yang tidak memiliki sifat-sifat seperti tercantum berikut adalah…
a. Jari-jari atom makin besar
b. Energi ionisasi makin besar
c. Massa jenis makin besar
d. Nomor atom makin besar
e. Titik lebur makin kecil
Pembahasan
Sifat-sifat unsur alkali :
- Nomor atom dari atas kebawah semakin besar
- Titik leleh dari atas kebawah semakin kecil
- Titik lebur dari atas kebawah makin kecil
- Jari-jari atom dari atas kebawah makin besar
- Energi ionisasi dari atas kebawah semakin kecil
- Massa jenis dari atas kebawah makin besar
Jawaban : B
18. Jari-jari 12Mg lebih kecil daripada 11Na Hal itu disebabkan oleh…
a. Jumlah kulit Mg lebih sedikit dari pada Na
b. Jumlah subkulit Mg lebih sedikit dari pada Na
c. Jumlah elektron Mg lebih sedikit daripada Na
d. Jumlah proton dalam inti Mg lebih banyak dari pada Na
e. Jumlah proton dalam inti Mg lebih sedikit daripasa Na
(kimia berbasis eksperimen untuk kelas XII, Sentot Budi Raharjo, Platinum, 2012, h.199)
Pembahasan :
Jika dibanding logam alkali, jari-jari atom maupun jari-jari ion yang iso elektronis (jumlah elektronnya sama) golongan alkali tanah lebih kecil (misalnya jari-jari Mg+2 dibanding Na+1).
Hal ini disebabkan oleh muatan inti golongan alkali tanah lebih besar dibandingkan golongan alkali, sedangkan jumlah kulit elektronnya sama.
Jawaban : D
19. Jika logam natrium dimasukan kedalam air, reaksi yang terjadi adalah….
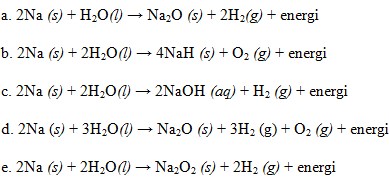
Pembahasan :
Reaksi logam natrium dengan air adalah sebagai berikut :
2Na (s) + 2H2O(l) → 2NaOH (aq) + H2 (g) + energi
Semua logam alkali bereaksi dengan air membentuk basa dan gas hidrogen.
Jawaban : C
20. Unsur logam alkali yang memberikan warna nyala berwarna merah adalah….
a. Natrium
b. litium
c. kalium
d. sesium
e. Barium
Pembahasan :
Jika logam alkali dibakar, akan menghasilkan warna nyala yang khas. Seperti, logam litium (Li) berwarna merah, natrium (Na) berwarna kuning, kalium (K) berwarna ungu muda, rubidium (Rb) berwarna ungu dan sesium (Cs) berwarna biru
Jawaban : B
21 – 40 Soal Kimia Unsur Pilihan Ganda dan Pembahasan
21. Unsur transisi yang paling banyak terdapat didalam kulit bumi adalah …
a. Krom
b. Mangan
c. Besi
d. Nikel
e. Tembaga
Jawaban : C
Pembahasan :
Besi (Fe) adalah unsur yang cukup melimpah di kerak bumi (sekitar 6,2% massa kerak bumi). Besi jarang ditemukan dalam keadaan bebas di alam. Besi umumnya ditemukan dalam bentuk mineral (bijih besi), seperti hematite (Fe2O3), siderite (FeCO3), dan magnetite (Fe3O4).
22. Dibawah ini yang termasuk macam-macam ligan adalah …
a. Ligan monodentat
b. Ligan okso
c. Ligan nitrat
d. Ligan siano
e. Ligan okasalat
Jawaban : A
Pembahasan
Yang termasuk macam-macam ligan adalah :
- Ligan monodentat : ligan yang menyumbangkan sepasang elektron pada atom pusat
- Ligan bidentat : ligan yang menyumbangkan dua pasang elektron pada atom pusat
- Ligan polidentat : ligan yang menyumbangkan lebih dari dua pasang elektron pada atom pusat
23. Unsur transisi periode 4 memiliki titik leleh dan titik didih yang tinggi karena, kecuali …
a. Rapatannya tinggi
b. jari-jari atom unsur yang relatif pendek
c. tingkat kepadatan antara atom-atom logam sangat tinggi
d. ikatan antar logam sangat kuat
e. jari-jari atom unsur yang relatif panjang
Jawaban : E
Pembahasan :
Unsur transisi periode 4 mempunyai titik didih dan titik leleh tinggi karena:
- Unsur-unsur transisi periode 4 mempunyai rapatan tinggi yang menunjukkan tingkat kepadatan antara atom-atom logam sangat tinggi
- Unsur-unsur transisi periode 4 mempunyai jari-jari atom unsur yang relatif pendek yang memungkinkan ikatan antaratom logam sangat kuat, yang di kenal dengan ikatan logam
24. Beberapa warna yang tampak pada ion mangan adalah sebagai berikut :
Mn2+ = merah muda
Mn6+ = hijau
Mn7+ = ungu
Senyawa mangan berikut yang mempunyai warna hijau adalah …
a. Mn(NO3)2
b. MnO2
c. KMnO4
d. K2MnO4
e. MnCl2
Jawaban : D
Pembahasan :
Karena biloks Mn pada K2MnO4 adalah +6
K2MnO4 = 0
(1 x 2) + Mn + (-2 x 4) = 0
2 + Mn + (-8) = 0
-6 = Mn
Mn = +6
25. Senyawa seng dari unsur transisi tidak berwarna, hal ini disebabkan oleh …
a. Orbital d telah penuh terisi elektron
b. Tidak adanya elektron pada orbital d
c. Orbital d telah terisi elektron setengah penuh
d. Tidak adanya elektron pada orbital s
e. Orbital s telah terisi elektron setengah penuh
Jawaban : A
Pembahasan :
Seng (Zn ) melepaskan dua elektronnya pada 4s ketika terkena energy cahaya, sedangkan semua electron pada 3d tetap penuh, sehingga semua gelombang cahaya itu dipantulkan semuanya , sehingga terlihat berwarna putih atau tidak berwarna.
Zn ( 30 ) = ( Ar ) 3d10 4s2
26. Unsur transisi yang bersifat feromagnetik adalah …
a. Sc
b. Ti
c. Cr
d. V
e. Co
Jawaban : E
Pembahasan :
Feromagnetik (Fero : besi : besi itu kuat) = Sifat magnet yang ditarik kuat ke medan magnet. Syaratnya adalah semakin banyaknya elektron tidak berpasangan atau lebih dari satu. Contohnya, Fe, Co, dan Ni.
Sifat Feromagnetik → Sifat ini dimiliki zat yang mempunyai atom-atom paramagnetik yang berada pada jarak sedemikian sehingga interaksi yang terjadi antara atom-atom begitu kuat.
27. Berdasarkan proses goldschmidt, kromium dibuat melalui cara ….
a. Elektrolisis leburan CrCl2
b. Reduksi Cr2O3dengan karbon pijar
c. Reaksi larutan Cr2(SO4)3dengan Ag
d. Reduksi Cr2O3 dengan Al
e. Pemanasan Cr2S3
Jawaban : D
Pembahasan :
Krom (Cr): logam krom dibuat menurut proses goldschmidt dengan jalan mereduksi Cr2O3 dengan logam aluminium. Reaksinya :
Cr2O3(s) + 2Al(s) → Al2O3(s) + 2Cr(s)
28. Jumlah unsur transisi periode keempat adalah …
a. 6 unsur
b. 8 unsur
c. 10 unsur
d. 12 unsur
e. 14 unsur
Jawaban : C
Pembahasan :
Unsur transisi merupakan kelompok unsur yang terletak pada blok d di dalam sistem periodik. Unsur transisi periode keempat umumnya memiliki elektron valensi pada subkulit 3d yang belum terisi penuh (kecuali unsur Seng (Zn) pada Golongan IIB).
Hal ini menyebabkan unsur transisi periode keempat memiliki beberapa sifat khas yang tidak dimiliki oleh unsur-unsur golongan utama, seperti sifat magnetik, warna ion, aktivitas katalitik, serta kemampuan membentuk senyawa kompleks.
Unsur- unsur transisi pada perioda 4 terdiri atas 10 unsur, yaitu :

29. Nama senyawa kompleks [Ag(CN)2]– …
a. Ion sianoargentat (I)
b. Ion disianoargentat (I)
c. Ion disianida argentat
d. Ion Trisianoargentat
e. Ion disianidaargentum (I)
Jawaban: B
Pembahasan:
Nama ion kompleks [Ag(CN)2]– adalah ion diasianoargentat (I)
Pemberian nama ion kompleks yang bermuatan negatif dimulai dengan nama ligannyakemudian di ikuti oleh nama atom pusat yang di tambah dengan akhiran at dan hanya satu kata. Bilangan oksidasi dari atom pusat di tulis dengan bilangan romawi dalam tanda kurung.
30. Air yang mengandung logam tembaga mempunyai batas maksimum, karena jika telah melebihi batas maksimum dapat menimbulkan dampak negative apabila dikonsumsi. Batas maksimum logam tembaga dalam air adalah….
a. 1 bpj
b. 2 bpj
c.3 bpj
d. 4 bpj
e. 5 bpj
Jawaban: A
Pembahasan:
Batas maksimum logam tembaga dalam air adalah 1 bpj. Air yang mengandung tembaga dengan kadar melebihi batas maksimum yang diperbolehkan dapat menimbulkan dampak berupa kerongkongan terasa kering, mual-mual, diare yang terus menerus dan iritasi pada lambung. Bpj adalah bagian perjuta.
31. Cat tembok sering digunakan dalam kehidupan sehari-hari yang mana mengandung senyawa kimia, salah satu diantaranya cat berwarna putih. Senyawa kimia yang terkandung dalam cat putih tersebut adalah….
a. V2O5
b. Cr
c. TiCl3
d. Fe
e. TiO2
Jawaban: E
Pembahasan:
TiO2 (titanium dioksida) adalah pigmen putih, selain itu dapat memberikan sifat cemerlang pada warna lain. Senyawa ini dapat digunakan untuk cat tembok.
V2O5 sebagai katalisator menggunakan proses Kontak , Cr untuk bahan pelapis besi atau alloy dalam baja. Fe untuk bahan bangunan, bahan pembuatan mesin. Dan TiCl3 sebagai katalisator untuk polimerisasi etena menjadi polietena.
32. Konfigurasi elektron yang menyatakan unsur transisi adalah …

Jawaban: B
Pembahasan :
Unsur transisi periode keempat adalah unsur yang electron valensinya terletak pada subkulit 3d yang belum terisi penuh kecuali unsur Zn.
33. Unsur-unsur berikut yang termasuk unsur transisi adalah …
a. Sr, Sc dan V
b. Ti, Cr dan Br
c. Fe, Co dan Na
d. Mn, Cu dan Zn
e. Mn, Sc dan Si
Jawaban : D
Pembahasan :

Jadi yang merupakan unsur transisi adalah Mn, Cu dan Zn
34. Menurut aturan IUPAC, anam yang benar untuk senyawa kompleks [Cr(NH3)5Cl]Cl2 adalah …
a. Pentaaminoklorokromium (III) klorida
b. Kloropentaaminokromium (III) diklorida
c. Krom (III) pentaaminokloroklorida
d. Monoklorokromium (III) pentaaminoklorida
e. dikloropentaaminomonoklorokrom (III)
Jawaban : A
Pembahasan :
Salah satu sifat dari unsur transisi deret pertama yaitu dapat membentuk berbagai macam ion kompleks. Adapun tata cara penamaan senyawa kompleks yaitu :
Nama ion kompleks baik kation maupun anion terdiri atas dua bagian yang ditulis sdalam satu kata. Bagian pertama menyatakan jumlah dan nama ligan, bagian kedua menyatakan nama ion pusat dan bilangan oksidasinya.
- Ligan : NH3 dan Cl-
- Kation kompleks : Cr+2
- Anion Kompleks : Cl-
Jumlah ligan dinyatakan dengan awalan angka dalam bahasa Yunani.
- Ligan NH3 = 5 (Penta)
- Ligan Cl- = 1 (Mono)
Nama ligan yang berupa anion mendapat akhiran “o” sedang ligan-ligan yang berupa molekul netral penamaannya tidak memounyai aturan khusus, jadi dihafalkan saja
Ligan NH3 : Pentaamino
Ligan Cl- : Kloro
Nama ion pusat pada kation kompleks sama dengan nama biasa dari ion pusat itu
Ion pusat Kation : kromium
Ion pusat anion : Diklorida
Nama ion pusat pada anion kompleks harus menggunakan nama IUPAC dan diberi akhiran at
Bila terdapat lebih dari sejenis ligan, maka urutan penulisannya berdasarkan urutan abjad dari nama ligan tsb
Maka nama senyawa tersebut adalah : pentaaminoklorokromium (III) klorida
35. Beberapa reaksi kimia sebagai berikut:
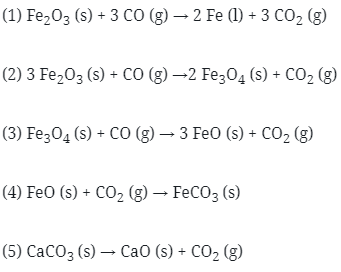
Reaksi yang terjadi pada peleburan besi pada tanur tinggi adalah….
a. 1,2 & 3
b. 1, 2, & 4
c. 2,3 & 4
d. 2,3 & 5
e. 2,4 & 5
Jawaban : A
Pembahasan:
Pengolahan bijih besi dilakukan di dalam tanur tinggi yang dikenal dengan namablast furnance. Proses pengolahan bjih adalah sebagai berikut.
Bijih besi, kokas dan kapur dimasukkan dari puncak tanur lalu udara panas diembuskan dari bawah. Reaksi yang terjadi pada tanur tinggi adalah sebagai berikut.
“Udara panas yang diembuskan kedalam tanur akan mengalir ke atas dan mengoksidasi kokas dengan reaksi eksoterm menghasilkan gas CO2. Kerika bergerak naik, gas CO2 yang baru terbentuk itu bereaksi lagi dengan kokas yang bergerak turun membentuk CO.
Reaksi eksoterm menyebabkan temperature pembakaran di dalam tanur tetap tinggi. Gas CO yang dihasilkan akan mereduksi bijih besi secara bertahap.
Fe2O3 → Fe3O4 → FeO → Fe
Jadi, reaksi total pada tanur adalah sebagai berikut.
Fe2O3 (s) + 3 CO (g) → 2 Fe (l) + 3 CO2
36. Pada proses tanur tinggi, bijih besi harus dicampur dengan kapur. Fungsi kapur adalah …
a. Mengikat SiO2
b. Mengikat oksigen
c. Mengikat kelebihan karbon
d. Menambah ion kalsium
e. Menghasilkan besi murni
Jawaban : A
Pembahasan :
Adapun bahan baku yang digunakan dalam proses tanur tinggi adalah
- Bujih besi hematit, magentit dengan kandungan SiO2 (lebih kurang 10 %), seedikit senyawa belerang, fosforus, aluminium, mangan
- Batu Kapur (CaCO3) untuk mengikat zat-zat pengotor (SiO2, P4O10, atau oksida amfoter seperti Al2O3)
- Kokas (C) sebagai bahan reduktor. C dapat mereduksi O2 sehingga terbentuk CO2. Gas CO2 yang panas akan naik dan mengoksidasi karbon membentuk gas CO. Gas CO yang terjadi secara bertahap mereduksi bijih besi
- Udara untuk mengoksidasi C sehingga membentuk CO
37. Ion Cu2+ dapat membentuk ion kompleks [Cu(NH3)4]2+ maka bilangan koordinasi ion Cu2+ adalah ….
a. 1
b. 2
c. 3
d. 4
e. 5
Jawaban : D
Pembahasan :
Bilangan koordinasi adalah jumlah ligan sederhana atau jumlah ikatan koordinasi yang dibentuk oleh ion pusat. Seringkali, bilangan koordniasi ion pusat sama dengan dua kali bilangan oksidasinya. Bilangan koordniasi yang umun adalah 2,4 dan 6
Bilangan koordinasi untuk ion pusat Cu2+ yang memiliki bilangan oksidasi +2 adalah 4. Selain melihat bilangan oksidasi lalu dikalikan dua, menenetukan bilangan koordniasi ion pusat dapat juga dilihat dari rumus molekul senyawanya yaitu [Cu(NH3)4]2+ dari rumus senyawa ini bilangan koordinasi berada sesudah tanda kurung ligan.
38. Dalam ion kompleks [Zn(NH3)4]2+ angka 4 menyatakan …
a. Bilangan koordinasi
b. Valensi (NH3)
c. Jumlah ikatan koordinasi
d. Muatan ion kompleks
e. Banyaknya ikatan ion
Jawaban : A
Pembahasan :
Bilangan koordinasi adalah jumlah ligan sederhana atau jumlah ikatan koordinasi yang dibentuk oleh ion pusat. Seringkali, bilangan koordniasi ion pusat sama dengan dua kali bilangan oksidasinya. Bilangan koordniasi yang umun adalah 2,4 dan 6
(Sentot Budi Raharjo, 2012, Kimia Berbasis Eksperimen kelas 3, Solo : Tiga serankai, h.203)
39. Pada proses pengolahan besi dari bijihnya, reaksi akhir untuk mendapatkan logam besi adalah ….
a. Fe3O4 + CO
b. Fe2O3 + CO
c. Fe2O3 + C
d. FeO + C
e. FeO + CO
Jawaban : E
Pembahasan :
Berikut rangkaian reaksi yang terjadi pada pengolahan bii besi dari bijihnya
- Udara dialirkan melalui dasar tungku sehingga bereaksi dengan krabon membentuk gas CO2. Reaksi in i bersifat eksoterm sehingga dapat menaikkan temperatur tungku sampai mendekati 1.900 oC
C + O2 → CO2
Gas CO2 yang panas naik dan mengoksidasi karbon membentuk gas CO
C + CO2 → 2 CO
Gas CO yang terjadi secara bertahap mereduksi bijih besi
3Fe2O3 + CO → 2Fe3O4 + CO2
(FE3O4 merupakan campuran FeO dan Fe2O3)
Fe3O4 + CO → 3FeO + CO2
FeO + CO → Fe + CO2
Besi yang terbentuk akan turun kebaah dan meleleh didasar tungku
40. Sifat unsur transisi periode keempat yang memiliki jari-jari atom yang paling besar adalah….
a. Mn
b. Cr
c. V
d. Ti
e. Sc
Jawaban : E
Pembahasan:
Jari-jari atom dipengaruhi oleh gaya tarik-menarik antara inti dan electron. Pada unsur transisi periode keempat dari Sc ke Ni terjadi penurunan jari-jari atom, karena meski terdapat lebih banyak electron di subkulit 3d, namun electron-elektron ini terikat semakin kuat keinti. Hal ini dikarenakan muatan inti bertambah positif dari kiri ke kanan.
| Unsur | Sc | Ti | V | Cr | Mn |
| Jari-jari Atom | 1.44 | 1.32 | 1.22 | 1.18 | 1.17 |
41 – 60 Contoh Soal Kimia Unsur Pilihan Ganda Beserta Pembahasannya
41. Sifat berikut tidak dimiliki oleh golongan halogen yaitu…
a. Unsure bebasnya berbentuk molekul diatomic
b. Titik didih dari atas kebawah semakin besar
c. Merupakan oksidator kuat
d. Mudah bereaksi dengan zat lain
e. Tidak bereaksi dengan air
Jawaban: E
Penyelesaian:
Secara umum, sifat kimia unsur-unsur halogen, antara lain sebagai berikut:
- Umumnya membentuk molekul diatomic, yaitu F2, Cl2, Br2, dan I2
- Mudah bereaksi dengan zat lain. Misalnya, reaksi iodide dengan asam sulfat menghasilkan gas hydrogen sulfide dan larutan triiodida yang berwarna
- Umumnya sukar larut dalam air, namun bereaksi dengan air
- Merupakan oksidator (pengoksidasi) kuat
42. Unsure halogen yang pada suhu kamar berwarna hijau muda adalah…
a. Fluorin
b. Klorin
c. Bromine
d. Iodine
e. Astatine
Jawaban: B
Pembahasan:
Pada suhu kamar, F2 merupakan gas berwarna kuning muda, Cl2 merupakan gas berwarna hijau muda, Br2 merupakan zat cair berwarna cokelat yang mudah menguap, dan I2 merupakan Kristal berwarna ungu gelap (mendekati hitam) mengilap seperti logam dan mudah menyublim.
43. Unsur halogen yang berwujud padat pada suhu kamar adalah…
a. Fluorin
b. Klorin
c. Bromine
d. Iodine
e. Astatine
Jawaban: D
Pembahasan:
Pada suhu kamar, fluorin dan klorin berupa gas, bromine berupa zat cair yang mudah menguap, sedangkan iodine berupa zat padat yang mudah menyumblim.
44. Diantara unsure halogen yang paling reaktif dan yang jauh kurang reaktif adalah….
a. Fluorin dan klorin
b. Klorin dan bromine
c. Bromine dan iodine
d. Fluorin dan iodine
e. Klorin dan iodine
Jawaban: D
Pembahasan:
Halogen merupakan kelompok unsure nonlogam yang paling reaktif. Namun demikian, kereaktifannya menurun dari fluorin keiodin. Hal itu sesuai dengan keelektronegatifan yang makin kecil dari fluorin keiodin. Fluorin adalah yang paling reaktif, dapat bereaksi dengan hampir semua unsure, termasuk dengan sebagian gas mulia.
Berbagai zat yang tahan api, seperti air asbes, terbakar dalam gas fluorin. Sedangan iodine jauh kurang reaktif. Reaksi-reaksi iodine seringkali memerlukan pemanasan atau katalis.
45. Diantara unsure-unsur halogen, yaitu fluorin, klorin, bromine, dan iodine. Manakah yang merupakan pengoksidasi terkuat?
a. Klorin
b. Fluorin
c. Bromine
d. Iodine
e. Semua salah
Jawaban : D
Pembahasan:
Halogen merupakan pengoksidasi kuat. Daya pengoksidasi halogen menurun dari atas kebawah pada sisitem periodic unsure, yaitu dari fluorin ke iodine. Sebaliknya, daya reduksi ion halide (X–) bertambah dari atas kebawah. Jadi, I– merupakan reduktor terkuat, sedangkan F– merupakan reduktor terlemah.
46. Halogen yang menyublim pada temperature kamar adalah…
a. Fluorin
b. Klorin
c. Bromine
d. Iodine
e. Astatine
Jawaban: D
Pembahasan :
Pada suhu kamar, fluorin dan klorin berupa gas, bromine berupa zat cair yang mudah menguap, sedangkan iodine berupa zat padat yang mudah menyumblim. Pemanasan iodine padat pada tekanan atmosfer tidak membuat unsure itu meleleh, tetapi langsung menguap (menyublim).
47. Kecenderungan sifat unsure halogen dari fluorin ke iodine adalah…kecuali
a. Jari-jari atom makin besar
b. Energy ionisasi makin besar
c. Kereaktifan berkurang
d. Sifat oksidator berkurang
e. Keelektronegatifan berkurang
Jawaban : B
Pembahasan:
Kecenderungan sifat unsure halogen dari fluorin ke iodine adalah:
- Jari-jari atom makin besar
- Energy ionisasi makin kecil
- Kereaktifan berkurang
- Sifat oksidator berkurang
- Keelektronegatifan berkurang
- Titik leleh dan titik didih makin tinggi
48. Senyawa dari unsure halogen yang dapat digunakan sebagai pemutih adalah…
a. HF
b. NaCl
c. NaClO
d. HCl
e. AgBr
Jawaban : C
Pembahasan:
Kegunaan unsure halogen dan senyawanya
- HF = untuk membuat tulisan diatas kaca
- Garam fluoride = campuran pada pasta gigi
- CF2Cl2 / Freon = pendingin
- NaCl = penyedap rasa, pengawet makanan, bahan pembuatan gas klorin.
- NaClO = pemutih
- Ca (OCl2) / kaporit = antiseptic
- HCl = untuk menghilangkan karat pada permukaan logam
- C2H2Br2 = zat aditif pada bensin
- AgBr = bahan pembuatan film
49. Unsure halogen tidak terdapat dalam keadaan bebas dialam, sebab….
a. Halogen bersifat teaktif
b. Unsure halogen sukar bereaksi dengan unsure lain
c. Senyawanya sangat stabil
d. Halogen merupakan gas inert
e. Halogen tidak mungkin terdapat dialam
Jawaban : A
Pembahasan:
Istilah halogen berasal dari Yunani yang berarti pembentuk garam. Di alam, tidak pernah didapatkan halogen dalam keadaan bebas sebagai unsurnya, tetapi selalu terdapat sebagai garamnya akibat besarnya kereaktifan unsure-unsur golongan halogen.
Penarikan electron oleh atom-atom halogen berlangsung mudah sehingga golongan halogen bersifat reaktif (dapat bereaksi dengan logam maupun dengan nonlogam). Akibatnya, dialam tidak diperoleh dengan keadaan bebas.
50. Iodin mudah larut dalam larutan kalium iodida meskipun sukar larut dalam air. Hal itu disebabkan oleh terbentuknya…
a. KI3–
b. KI2–
c. KI+
d. KI3
e. KI2
Jawaban: D
Pembahasan :
Karena iodine mudah larut dalam iodine beratom 3 tapi dalam bentuk ion, yaitu I3– . I3– didapatkan dari reaksi ionisasi KI3 yaitu:
KI3 → K+ + I3–
(Kimia Berbasis Eksperimen untuk kelas XII SMA dan MA. Platinum, Sentot Budi Rahardjo. 2015. Hal : 199)
51. Beberapa senyawa atau produk yang mengandung unsure halogen adalah…
a. Senyawa frenon, peptisida, dan etilen
b. Senyawa frenon, peptisida, Xenon
c. Senyawa peptisida, etilen, Xenon
d. Senyawa etilen, Xenon, Kripton
e. Semua benar
Jawaban : A
Pembahasan :
Beberapa senyawa atau produk yang mengandung unsure halogen adalah
- Fluorin terdapat dalam senyawa frenon seperti CCl2F2 dan plastic tahan panas yang dikenal dengan Teflon, bentuk polimer dari C2F4
- Klorin terdapat dalam senyawa peptisida seperti DDT, aldrin, dan dieldrin.klorin juga terdapat dalam produk polimer seperti PVC
- Bromine terdapat dalam senyawa etilen dibromida C2H4Br2 , sebuah komponen bensin etil pengganti senyawa timbale yang berfungsi sebagai zat anti ketukan
- Iodine terdapat dalam senyawa iodoform CHl3, zat berwarna kuning dan mempunyai bau khas dan digunakan sebagai obat antiseptic untuk luka
(Kimia untuk SMA/MA kelas XII, Erlangga: Unggul Sudarmo. 2013. Hal: 93)
52. Pernyataan berikut yang tidak benar mengenai halogen adalah…
a. Umumnya mempunyai afinitas electron yang besar
b. Diantara unsure seperiode termasuk unsure yang mempunyai energy ionisasi besar
c. Dialam hanya terdapat sebagai senyawa halide
d. Merupakan unsure reaktif dan dapatt berlangsung membentuk garam dengan logam
e. Dari fluorin ke astatine daya oksidasinya semakin lemah
Jawaban : C
Pembahasan:
Halogen tidak hanya terdapat dalam senyawa halide saja, melainkan banyak seperti senyawa oksigen halogen, oksida halogen.
(Kimia Berbasis Eksperimen untuk kelas XII SMA dan MA. Platinum, Sentot Budi Rahardjo. 2015. Hal : 137)
53. Halide berikut yang paling mudah terurai menjadi atom-atomnya adalah..
a. HF
b. HI
c. HCl
d. HBr
e. Cl2
Jawaban: E
Pembahasan:
Option a sampai d salah karena energy disosiasi senyawa lebih rendah dari pada energy disosisasi unsure. Jadi jawaban yang tepat adalah unsure klorin.
(SPM untuk SMA/MA. Esis:Mustafal Bakri. 2012. Hal:114)
54. Energi disosiasi ikatan F2 lebih rendah dari pada Cl Hal ini disebabkan…
a. Massa atom klorin lebih besar dari pada fluorin
b. Kerapatan electron klorin lebih rendah dari pada fluorin
c. Diantara halogen, fluorin mempunyai jari-jari atom terkecil
d. Klorin merupakan halide yang berwujud gas pada suhu kamar
e. Daya oksidasi fluorin terkuat diantara halogen
Jawaban : B
Pembahasan:
A: salah karena ukuran atomlah yang menyebabkan klorin memiliki energy disosiasi > fluor , bukan massanya
C: salah karena tidak ada hubungannya
D: salah karena klorin dan fluor sama-sama berwujud gass, bukan klorin saja
E: salah karena daya oksidasi tidak ada hubungannya dengan energy disosiasi
(Kimia untuk SMA/MA kelas XII, Erlangga: Unggul Sudarmo. 2013. Hal: 103)
55. Senyawa halogen yang digunakan sebagai bahan pembunuh kuman dan penghilang bau adalah…
a. Tetraklorometana
b. Natrium klorat
c. Kapur klor
d. Natrium iodat
e. Klorofluorokarbon
Jawaban : C
Pembahasan:
Kapur klor (CaOCl2) merupakan garam rangkap CaCl2 dan CaOCl2 digunakan sebagai bahan pembunuh kuman dan penghilang bau.
(Kimia untuk SMA/MA kelas XII, Erlangga: Unggul Sudarmo. 2013. Hal: 105)
56. Manakah dari reaksi-reaksi berikut yang berlangsung tidak spontan
a. KCl + Br ↔ 2KBr + Cl2
b. Cl2 + 2KI ↔ 2KI + I2
c. Br2 + CaI2 ↔ CaBr2 + I2
d. Si + 2F2 —> SiF4
e. H2 + Br2 —> 2HBr
Jawaban : A
Penyelesaian :
Berdasarkan table priodik, reaksi antar halogen spontan terjadi antara unsur halogen ( X2 ) yang lebih diatas dengan anion yang dibawahnya ( Y ) dari table priodik .
Kespontanan reaksi ini juga dapat ditinjau berdasarkan nilai E0SEL –nya . reaksi spontan memiliki E0SEL = +
- E0sel = E0 Br2/Br– – E0 Cl2/Cl– = 1,07 -1,36 = 0,29 v tdk spontan
- E0sel = E0 Cl2/Cl– – E0 I2/ I– = 1,36 – 0,54 = +0,82 v spontan
- E0sel = E0 Br2/Br– – E0 I2/ I– = 1,07 -0,54 = + 0,53 v
Reaksi a) Cl– + Br+ ↔ 2Br + Cl2 tidak spontan karena dalam table priodik Br dibawah Cl.
Reaksi b) dan c) bersangsung secara spontan karena Cl diatas Br dan I
57. Halogen yang memiliki sifat reduktor terkuat adalah …
a. F2
b. Cl2
c. Br2
d. I–
e. F–
Jawaban : D
Penyelesaian :
Jika dilihat pada sifat-sifat halogen yang berperan sebagai oksidator kuat dalam suatu reaksi redoks, yang berarti dalam suatu reaksi redoks terdapat sifat sifat halogen yang sebagai oksidator ( penaikan /penambahan biloks) seperti F2> Cl2> Br2 > I2 dan sebagai reduktor (penurunan/pengurangan biloks) seperti F–< Cl–< Br–< I– , jika yang ditanya adalah reduktor yang terkuat adalah I– .
58. Reaksi berikut yang tidak dapat berlangsung adalah …
a. Larutan KI dengan gas Br2
b. Larutan KI dengan gas Cl2
c. Larutan KCl dengan gas Br2
d. Larutan KBr dengan gas I2
e. Larutan KCl dengan gas F2
Jawaban : D
Penyelesaian:
Berdasarkan table priodik, reaksi antar halogen spontan terjadi antara unsur halogen (X2) yang lebih diatas dengan anion yang dibawahnya (Y) dari table priodik .
Kespontanan reaksi ini juga dapat ditinjau berdasarkan nilai E0SEL –nya . reaksi spontan memiliki E0SEL = +
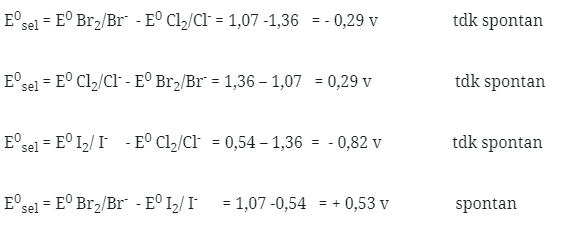
59. Pada suhu kamar, karakteristik unsur-unsur halogen adalah :
- F2 dan Cl2 berwujud gas
- Br2 bersifat cair
- I2 bersifat padat
- At bersifat radioaktif
Jawaban yang benar adalah…
a. (1), (2), dan (3)
b. (1) dan (3)
c. (2), dan (4)
d. (4) saja
e. Semua benar
Jawaban : A
Penyelesaian :
pada suhu kamar ( 250c )
F2 berwujud gas
Cl2 berwujud gas
Br2 bersifat cair
I2 bersifat padat dan
At bersifat padat
60. Berdasarkan sifat periodic unsur-unsur halogen, HF diharapkan memiliki titik didih paling rendah dibandingan dengan HCl, HBr, dan HI. Pada kenyataannya HF mempunyai titik didih yang paling tinggi karena HF mempunyai ikatan…
a. Ion
b. Hydrogen
c. kovalen
d. London
e. Dipol-dipol
Jawaban : A
Penyelesaian:
atom f mempunyai harga elektronegatifitas yang besar, yaitu terlihat bahwa titik didih halogen semakin tinggi hal itu disebabkan fluorin ke iodin ukuran molekulnya bertambah besar ( jari-jari ion) sehingga gaya van deer waals makin besar. Akibatnya energy yang diperlukan untuk memperkecil gaya van der waal tersebut makin tinggi.
61 – 80 Soal Kimia Unsur dan Pembahasan
61. Pernyataan di bawah ini yang merupakan sifat gas mulia adalah. . .
a. Terletak pada sisitem periodik pada periode ke delapan
b. Nomor atom terkecil adalah 8
c. Sangat reaktif
d. Elektron pada kulit terluarnya 8, kecuali He
e. Merupakan molekul diatomik
Jawaban : D
Pembahasan:

62. Gas mulia yang terbanyak di atmosfer adalah. . .
a. Helium
b. Neon
c. Argon
d. Kripton
e. Xenon
Jawaban : C
Pembahasan
Gas mulia yang terdapat di atmosfer adalah argon. Argon diurutan ketiga setelah nitrogen dan oksigen.
(Iis Rusmiati. Kumpulan Rumus Lengkap Kimia. Hal.251)
63. Unsur gas mulia yang bersifat duplet adalah. . .
a. Helium
b. Neon
c. Argon
d. Kripton
e. Radon
Jawaban : A
Pembahasan:
Dalam tabel periodik unsur-unsur gas mulia terdapat pada golongan VIII A, jadi letaknya paling kanan. Dengan konfigurasi elektron kulit terluar terisi penuh maka atom-atom gas mulia mempunyai susunan elektron yang sangat stabil, yaitu susunan oktet dan khusus helium mempunyai susunan duplet.
64. Manakah sifat gas mulia yang makin berkurang dengan bertambahnya nomor atom. . .
a. Energi ionisasi
b. Volume atom
c. Titik didih
d. Titik leleh
e. Keelektronegatifan
Jawaban : A
Pembahasan
Sifat umum gas mulia:
- Jari-jari atomnya semakin besar, akibatnya dari He ke Rn semakin mudah membentuk dipol sesaat dan gaya van der waals semakin kuat.
- Semakin kuatnya gaya van der waals (dari He ke Rn) menyebabkan titik didih dan titik leleh gas mulia dari atas ke bawah semakin tinggi.
- Energi ionisasinya semakin kecil, bahkanuntuk Xe dan Rn mempunyai energi ionisasi yang lebih rendah dari hidrogen (energi ionisasi hidrogen: 1.312 kJ/mol)
(Unggul Sudarmo. Kimia 3. Erlangga. 2013. Hal.87)
65. Untuk memperoleh gas mulia dapat dilakukan melalui. . .
a. Destilasi bertingkat udara cair
b. Pencairan udara dan penguapan gas mulia
c. Pendinginan udara kemudian didestilasi
d. Penyulingan udara murni
e. Pemurnian udara dan penguapan gas mulia
Jawaban : A
Pembahasan:
Cara memperoleh gas mulia yaitu melalui destilasi udara cair. Mula-mula udara dicairkan dengan pemampatan (memeberikan tekanan tinggi). Udara cair tesebut kemudian didestilasi bertingkat. Destilasi bertingkat adalah pemisahan campuran berdasarkan perbedaan titik didih masing-masig komponendalam campuran. Udara merupakan campuran gas, debu yang sangat halus merupakan pengotor yang harus dibersihkan.
66. Helium tergolong gas mulia, sebab. . .
a. Nomor atomnya 2
b. Elektronnya mengisi orbital s
c. Elektron valensinya 2
d. Sifatnya mirip neon
e. Pada suhu kamar berwujud gas
Jawaban : D
Pembahasan:
Helium, He tergolong gas mulia karena sifatnya mirip neon yang berada dibawah He dalam sistem periodikkemiripan unsur dalam sistem periodik terdapat dalam golongan yang sama, sedangkan suatu periode terdapat unsur-unsur yang sifatnya berubah secara teratur sesuai dengan perubahan bertambahnya jumlah proton. Walaupun nomor atom He 2 dan terdapat dalam orbital 1s, konfigurasi elektron 1s2 digolongkan kedalam gas mulia.
Neon nomor atom 10, konfigurasi elektron terluar 2s2 2p6 dan unsur-unsur gas mulia lainnya, elektron balensinya memenuhi oktet, sedangkan He duplet. Diantara kemiripan sifatnya adalah kestabilannya dan dialam sebagai molekul monoatomik.
67. Berikut yang bukan termasuk kegunaan dari Neon adalah. . .
a. Membuat indikator tegangan tinggi
b. Zat pendingin pada refrigerator untuk tegangan rendah
c. Pemberi tanda pada pesawat terbang
d. Pembuat tabung elektron
e. Pembuat lampu-lampu iklan
Jawaban : D
Pembahasan:
Kegunaan neon dalam kehidupan sehari-hari, sebagai berikut:
- Membuat lampu-lampu iklan karena menyebabkan terjadinya nyala yang berwarna merah terang jika dialiri arus listrik.
- Membuat indikator tegangan tinggi, penangkal petir, tabung televisi, dan laser gas.
- Neon cair merupakan zat pendingin pada refregirator untuk temperatur rendah.
- Sebagai pemberi tanda pada pesawat terbang karena sinarnya dapat menembus kabut.
(Tine Maria Kusnawati. Sains Kimia 3. Bumi Aksara. Hal.94-95)
68. Gas mulia yang dapat disintesis membentuk senyawa dengan unsur lain adalah. . .
a. Xe dan Kr
b. Kr dan Ar
c. He dan Kr’
d. Xe dan Ar
e. He dan Ar
Jawaban : A
Pembahasan:
He, Ar, dan Na tidak dapat membentuk senyawa. Kr membentuk senyawa KrF2 dan KrF6, sedangkan Xe dapat membentuk senyawa XeF2 dan XeF6
( Nana Sutresna. Kimia 3. Grafindo. Hal. 89)
69. Unsur gas mulia dari Ar hingga Xe dengan kondisi tertentu dapat direaksikan dengan unsur yang paling. . .
a. Ringan
b. Kecil
c. Tidak stabil
d. Mudah bereaksi
e. Elektronegatif
Jawaban : E
Pembahasan:
Elektron yang aling elektronegatiflah yang memiliki daya tarik terbesar terhadap elektron gas mulia, karena unsur elektronegatif bebrarti memiliki daya tarik besar terhadap elektron. Unsur ini adalah unsur non logam, maka ikatan kimia yang terbentuk adalah kovalen.
( Iis Rusmiati. Kumpulan Rumus Lengkap Kimia. Hal.258)
70. Unsur gas mulia yang bersifat radioaktif adalah. . .
a. Helium
b. Neon
c. Kripton
d. Xenon
e. Radon
Jawaban : E
Pembahasan:
Radon bersifat radioaktif, gas ini seringa digunakan untuk terapi terhadap penderita penyakit kanker.
71. Unsur-unsur periode 3 terdiri atas: Na, Mg, Al, Si, P, S, Cl, dan Ar. Atas dasar konfigurasi elektronya dapat dikatakan bahwa…
a. Na, Mg dan Al adalah unsure non logam
b. Oksida dari Si bersifat basa dalam air
c. P, S, dan Cl cenderung membentuk basa
d. Klor bersifat pereduksi kuat
e. Jari-jari atom Ar paling
Jawaban : E
Sifat-sifat unsur periode ketiga :
- Jeri-jari atom semakin kekiri semakin besar
- Keelektronegatifan semakin kekanan semakin besar
- Energi ionisasi semakin kanan semakin besar
- Titik didih dan titik leleh semakin kekiri semakin besar
( Wuri, Dian Astuti, dkk. 2009. Bahas Tuntas 1001 soal Kimia SMA kelas X, XI, dan XII. Yogyakarta: Pustaka Widyatama. hlm 50. No. 25)
72. Unsur periode ketiga yang bersifat amfoter…
a. Natrium
b. Klori
c. Fosforus
d. magnesium
e. Alumunium
Jawaban : E
Alumunium bersifat amfoter, yaitu dapat bersifat asam maupun basa
( Wuri, Dian Astuti, dkk. 2009. Bahas Tuntas 1001 soal Kimia SMA kelas X,
XI, dan XII. Yogyakarta: Pustaka Widyatama. hlm 50. No. 26)
73. Dari pertanyaan :
- (1) Kristal molekul sederhana
- (2) Kristal molekul raksasa
- (3) Kristal logam raksasa
- (4) Atom-atom molekul yang berdiri sendiri
Maka unsur-unsur periode 3 dari Na sampai Ar menunjukan perubahan struktur dalan urutan sebagai berikut… (suhu 200C)
a. 4,3,2,4
b. 1,2,3,4
c. 3,2,1,4
d. 4,1,2,3
e. 3,2,4,1
Jawaban : C
Perubahan struktur pada periode ketiga :
- Kristal logam : Na, Mg, Al
- Kristal kovalen raksasa : Si
- Kristal molekul sederhana : P,S,Cl
- Monoatomik : Ar
( Wuri, Dian Astuti, dkk. 2009. Bahas Tuntas 1001 soal Kimia SMA kelas X, XI, dan XII. Yogyakarta: Pustaka Widyatama. hlm 50. No. 24)
74. Pasangan hidroksida yang bersifat asam adalah….
a. Si(OH)4 dan Mg(OH)2
b. Si(OH)4 dan P(OH)5
c. Mg(OH)2 dan Al(OH)3
d. S(OH)6 dan Mg(OH)2
e. NaOH dan S(OH)
Jawaban : B
Pasangan hidroksida yang bersifat asam adalah Si(OH)4 dan P(OH)5. Reaksi hidroksida asam : P(OH)5 : asam lemah, Si(OH)4: asam lemah, S(OH)6 : asam kuat : Cl(OH)7 : asam kuat.
NaOH : basa kuat, Mg(OH)2 : basa lemah : Al(OH)3 : basa yang sangat lemah.
(Mustafa Bakri.2012. Seri Pendalaman Materi KIMIA. Jakarta: Erlangga; Esis. Hlm 122. No. 15)
75. Alumunium tergolong logam tahan korosi. Sifat inilah yang menyebabkan alumunium dipakai dalam industri kecil…
a. Untuk membuat logam campur
b. Untuk membuat reaksi termit
c. Sebagai pereduksi berbagai macam oksida
d. Untuk membuat berbagai peralata dapur
e. Untuk membuat roda pesawat terbang
Jawaban : D
Alumunium merupakan logam yang cukup reaktif, sifat reduktornya cukup baik. Tetapi, Al adalah logam yang tahan korosi karena alumunium membentuk lapisan Al2O3 yang akan melindunginya dari korosi.
(Mustafa Bakri.2012. Seri Pendalaman Materi KIMIA. Jakarta: Erlangga; Esis. Hlm 122. No. 19
76. Oksida unsure periode ke tiga yang paling bersifat asam jika dilarutkan dalam air adalah ….
a. Cl2O7
b. SiO2
c. P2O6
d. Al2O3
e. MgO
Jawaban : A
Klor (VII) oksida jika bereaksi dengan air akan menghasilkan asam yang sangat kuat, asam Klor (VII) dikenal juga sebagai asam perklorat. pH larutan secara umum sama dengan asam sulfat = 0.
Cl2O7 + H2O → 2HClO4
Sedangkan Si dan Mg tidak dapat bereaksi dengan air, sementara pospor dapat menjadi asam lemah, sementara almunium oksida tidak dapat bereaksi secara sederhana dengan air seperti natrium oksida dan magnesium oksida dan tidak larut dalam air.
(Mustafa Bakri.2012. Seri Pendalaman Materi KIMIA. Jakarta: Erlangga; Esis. Hlm 127. No. 44)
77. Sifat oksidator unsur periode ke tiga yang paling kuat adalah ….
a.klorin
b. belerang
c. magnesium
d. fosforus
e. natrium
Jawaban : A
pada unsur-unsur periode ketiga unsure logam dari kiri kekanan sifat reduktornya berkurang, artinya disini semakin kekanan maka unsur semakin mudah direduksi yang artinya semakin kekanan merupakan oksidator paling kuat → Na, Mg, Al, Si, P, S, Cl, Ar
(Parning , horale. 2005. KIMIA 3 SMA KELAS XII. Jakarta. Yudhistira. Hlm 241. No. 25 )
78. Senyawa hidroksida dari unsure periode ketiga dirumuskan sebagai berikut. Si(OH)4, P(OH)5, S(OH)6, Cl(OH) Urutan kekuatan sifat asam dari senyawa hidroksida adalah ….
a. Cl(OH)7> S(OH)6> P(OH)5> Si(OH)4
b. Si(OH)4> P(OH)5> S(OH)6> Cl(OH)7
c. P(OH)5> Cl(OH)7> Si(OH)4>S(OH)6
d. S(OH)6> P(OH)5> Cl(OH)7> Si(OH)4
e. Cl(OH)7> P(OH)5> S(OH)6> Si(OH)4
Jawaban : A
Urutan yang paling kuat sifat asamnya dari senyawa hidroksida unsure periode ketiga yaitu pada : → Cl(OH)7> S(OH)6> P(OH)5> Si(OH)4
- Cl(OH)7> Asam yang sangat kuat
- S(OH)6> asam kuat
- P(OH)5> asam lemah
- Si(OH)4 > asam lemah
( Parning , horale. 2005. KIMIA 3 SMA KELAS XII. Jakarta. Yudhistira. Hlm241. No. 26 )
79. Sifat asam unsur periode ke tiga berikut ini yang paling kuat adalah
a. H2SiO3
b. H2SO4
c. HAlO2
d. H3PO4
e. HClO4
Jawaban : E
Sifat asam yang paling kuat adalah HClO4. Jika energi ionisasinya kecil, maka mudah untuk melepaskan elektron sehingga larutan tersebut bersifat basa, kemudian sebaliknya jika energi ionisasinya besar maka mudah menerima elektron sehingga larutan bersifat asam.
HClO4 : asam sangat kuat > H2SO4 : asam kuat > H3PO4 : asam lemah > H2SiO3 :asam sangat lemah > HAlO2 : amfoter.
(Parning, horale. 2005. KIMIA 3 SMA KELAS XII. Jakarta. Yudhistira. Hlm 186. No. 30 )
80. Pada pembuatan asam sulfat dengan proses kontak, ditambahkan katalis berupa …
a. P2O5
b. V2O5
c. Fe2O3
d. CoCl2
e. MnO2
Jawaban : B
V2O5,. Pada proses kontak digunakan suhu sekitar 5000C dengan katalisator V2O5.
(Unggul Sudarmo. 2013. KIMIA 3 SMA KELAS XII. Jakarta. Erlangga. Hlm 177. No. 10 )

