Contoh Soal Sistem Periodik Unsur (SPU) dan Jawaban beserta Pembahasan – Sistem periodik unsur merupakan susunan unsur-unsur berdasarkan urutan nomor atom dan kemiripan sifat unsur-unsur tersebut. Alasan mengapa disebut “periodik”, sebagaimana terdapat pola kemiripan sifat unsur dalam susunan tersebut. Sistem periodik unsur (tabel periodik) modern yang saat ini digunakan didasarkan pada tabel yang dipublikasikan oleh Dmitri Mendeleev pada 1869.
Berikut ini adalah Pertanyaan Sistem Periodik Unsur untuk kamu pelajari persiapan ulangan harian dan melatih kemampuan kimia kamu yang berjumlah 20 butir soal .
1 – 10 Soal Sistem Periodik Unsur (SPU) dan Jawaban
1. Letak unsur dan konfigurasi elektron yang tepat untuk unsur 19X adalah…(nomor atom Ar = 18)
A. Periode 4, golongan IA, [Ar] 4s1
B. Periode 1, golongan IB, [Ar] 4d1
C. Periode 1, golongan IIA, [Ar] 4s2
D. Periode 2, golongan IIB, [Ar] 4d2
E. Periode 3, golongan IVA, [Ar] 4s2 3d2
Jawaban : A
Pembahasan :
menentukan letak unsur
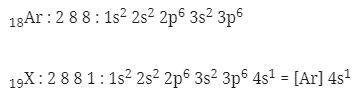
n = 4 → periode 4
eval = 1 → golongan IA
2. Harga keempat bilangan kuantum elektron terakhir dari atom 16S adalah…
A. n = 2, l = 0, m = 0, s = -1/2
B. n = 3, l = 1, m = -1, s = -1/2
C. n = 3, l = 1, m = 0, s = -1/2
D. n = 3, l = 1, m = 0, s = +1/2
E. n = 3, l = 1, m = +1, s = +1/2
Jawaban : B
Pembahasan :
Menentukan harga bilangan kuantum
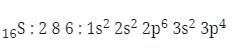
Elektron terakhir berada pada orbital 3s 3p
Untuk orbital 3s :
- n = 3, l = 0, m = 0, s = +1/2
- n = 3, l = 0, m = 0, s = -1/2
Untuk orbital 3p
- n = 3, l = 1, m = +1, s = +1/2
- n = 3, l = 1, m = 0, s = +1/2
- n = 3, l = 1, m = -1, s = +1/2
- n = 3, l = 1, m = -1, s = -1/2
Untuk Soal SPU nomor 3 dan 4
Dua unsur memiliki diagram orbital sebagai berikut :
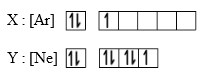
3. Nomor atom dari unsur X adalah…
A. 17
B. 18
C. 21
D. 26
E. 30
Jawaban : C
Pembahasan :
menentukan nomor atom
Ar dan Ne merupakan golongan gas mulia (VIIIA). Akan sangat membantu jika kita sudah hafal nomor atom dan nomor massa golongan gas mulia karena terkadang dalam soal tidak disebutkan nomor atomnya karena dianggap sudah harus mengerti.
Nomor atom Ar = 18
Nomor atom X = Ar + 3 = 18 + 3 = 21
4. Unsur Y dalam sistem periodik unsur terletak pada periode dan golongan…
A. IIIA, 3
B. IIIB, 4
C. VA, 3
D. VIIA, 3
E. VIIB, 4
Jawaban : D
Pembahasan :
menentukan letak unsur
Nomor atom Ne = 10
Nomor atom Y = Ne + 7 = 10 + 7 = 17
![]()
Dari konfigurasi elektron tersebut dipeoleh :
n = 3 → periode 3
eval = 7 → golongan VIIA
5. Konfigurasi elektron X2- dari suatu unsur 16X adalah…

Jawaban : C
Pembahasan :
menentukan konfigurasi elekton
Unsur x membentuk ion negatif seperti di atas berbarti menerima 2 elektron sehingga jumlah elektronnya menjadi :
Baca Juga : 60+ Soal Laju Reaksi Pilihan Ganda dan Kunci Jawaban Lengkap dengan Pembahasan
6. Letak unsur X dengan nomor atom 26 dan nomor massa 56 dalam sistem periodik unsur terletak pada golongan dan periode…
A. IIA dan 6
B. VIB dan 3
C. VIB dan 4
D. VIIIB dan 3
E. VIIIB dan 4
Jawaban : E
Pembahasan :
Menentukan letak unsur
![]()
Ingat bahwa 4s 3d merupakan salah satu karakteristik konfigurasi elektron unsur golongan B. Dari konfigurasi di atas diperoleh :
n = 4 → periode 4
eval (s+d) = 2 + 6 = 8 → golongan VIIIB
(Ujian nasional 2009/2010)
Untuk soal SPU no 7 – 8
Tiga unsur memiliki notasi seperti di bawah ini :
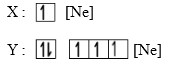
7. Nomor atom dari unsur X adalah…
A. 1
B. 3
C. 5
D. 10
E. 11
Jawaban : E
Pembahasan :
Jika pada soal tidak diketahui nomor atom Ne, maka tugas menghafal unsur golongan IA sampai VIIIA pada saat-sat seperti ini harus dapat diandalkan. Untuk tingkat SMA, akan sangat membantu jika murid menghafal golongan-golongan utama.
Atom Ne berada pada golongan gas mulia (VIIIA), periode 2 berarti nomor atomnya 10.
Nomor atom Ne = 10
Nomor atom X = Ne + 1 = 11
8. Unsur Y dalam sistem periodik unsur terletak pada periode dan golongan…
A. IIA, 5
B. IIA, 6
C. IIA, 7
D. IVA, 5
E. VA, 3
Jawaban : E
Pembahasan :
menentukan letak unsur
Nomor atom Y = Ne + 5 = 15
![]()
(Ujian nasional 2008/2009)
Untuk soal SPU no 9 – 11
Tiga unsur memiliki notasi seperti di bawah ini :
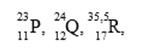
9. Konfigurasi elektron dari unsur P adalah… (nomor atom Ne = 10, Ar = 18)
A. [Ne] 3s¹
B. [Ne] 4s¹
C. [Ar] 3s¹
D. [Ar] 4s¹
E. [Ar] 4s² 3d¹
Jawaban : A
Pembahasan :
Konfigurasi elektron Aturan Aufbau
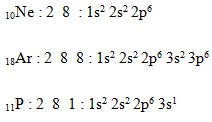
Bila dinyatakan dalam konfigurasi Ne dan Ar, maka konfigurasi elektron unsur P adalah sebagai berikut :
![]()
Jadi, dari kelima opsi yang diberikan, opsi A adalah opsi yang benar.
10. Konfigurasi elektron dari unsur Q jika membentuk ion ditunjukkan pada gambar…
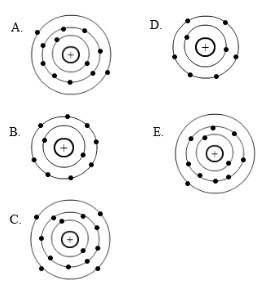
Jawaban : B
Jawaban :
Konfigurasi elektron model atom Bohr
12Q : 2 8 2
Berdasarkan konfigurasi elektronnya, unsur Q terletak pada golongan IIA. Jika membentuk ion, unsur pada golongan IIA akan cenderung melepas elektron sebanyak 2 elektron sehingga menjadi ion positif dengan muatan +2 sehingga jumlah elektronnya tinggal 10.
10Q : 2 8
Berdasarkan konfigurasi di atas, maka model atom Bohr yang sesuai adalah gambar pada opsi B.
11 – 20 Soal Sistem Periodik Unsur dan Pembahasan
11. Unsur 16T dalam sistem periodik unsur terletak pada golongan dan periode berturut-turut…
A. IVA, periode 3
B. VA, periode 2
C. VIA, periode 3
D. VIIA, periode 3
E. IVB, periode 2
Jawaban : C
Pembahasan :
menentukan letak unsur
![]()
Menurut atom Bohr, unsur T memiliki 3 kulit dan 6 elektron valensi maka T terletak pada periode 3 golongan VIA. Hal ini jelas terlihat dari konfigurasi elektronnya.
(Ujian Nasional 2007/2008)
Untuk Soal SPU nomor 12 – 14
Duah buah unsur memiliki notasi seperti di bawah ini :
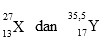
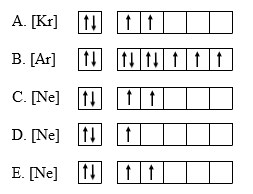
12. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur X adalah… (nomor atom Ar = 18, Kr = 36, Ne = 10)
Jawaban : D
Pembahasan :
konfigurasi elektron aturan Hund.
Melihat opsi jawaban pada soal di atas, maka yang harus kita lakukan adalah menentukan susunan elektron dalam unsur X berdasarkan aturan Hund dan menghubungkannya dengan unsur-unsur yang diketahui pada soal.
Karena no atom unsur X adalah 13, maka unsur yang mungkin digunakan untuk menyatakan konfigurasi elektron X adalah Ne dengan nomor atom 10. Secara sederhana, konfigurasi kedua unsur itu dapat kita tulis sebagai berikut :
10Ne : 2 8
13X : 2 8 3 → 13X : [Ne] 3
Selanjutnya berdasarkan aturan Hand, maka diagram orbital unsur X adalah sebagai berikut :
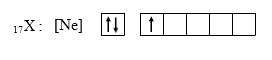
13. Unsur Y dalam sistem periodik terletak pada…
A. golongan IVB, periode 5
B. golongan VIIIB, periode 4
C. golongan IVA, periode 3
D. golongan VIIA, periode 3
E. golongan VIIIA, periode 3
Jawaban : D
Pembahasan :
menentukan letak unsur.
Untuk menentukan letak unsur dalam sistem periodik kita dapat melihatnya berdasarkan konfigurasi elektron menggunakan aturan Aufbau. Tapi karena no atom unsur Y terbilang sederhana, kita dapat menentukan konfigurasi elektronnya secara sederhana seperti berikut :
17Y : 2 8 7 → ada 3 kelas dengan 7 elektron di kulit terluar.
Jadi, unsur Y berada pada golongan VIIA periode 3.
14. Bila kedua unsur tersebut berikatan, maka rumus senyawa yang dihasilkan adalah…
A. XY2
B. XY3
C. X2Y
D. X3Y
E. X2Y3
Jawaban : E
Pembahasan :
menentukan rumus senyawa.
Untuk mengetahui rumus senyawa yang dihasilkan, kita perlu melihat berapa elektron yang dilepas atau diterima oleh masing-masing unsur.
Untuk itu, akan sangat membantu jika kita mengetahui konfigurasi elektron ataupun letak mereka di sistem periodik secara sederhana seperti berikut :
13X : 2 8 3 → golongan IIIA melepas 3 elektron
17Y : 2 8 7 → golongan VIIA menerima 1 elektron
Jadi, rumus senyawa yang terbentuk adalah XY3.
(Ujian Nasional 2006/2007)
15. Isotop unsur di bawah ini terdiri dari…
![]()
A. 13 proton, 14 elektron, dan 27 neutron
B. 13 proton, 13 elektron, dan 27 neutron
C. 13 proton, 13 elektron, dan 14 neutron
D. 14 proton, 14 elektron, dan 13 neutron
E. 27 proton, 27 elektron, dan 14 neutron
Jawaban : C
Pembahasan :
Jumlah proton, elektron, dan neutron.
Untuk emngerjakan soal seperti ini, kita harus mengingat kembali bagaimana notasi unsur. Notasi unsur pada umumnya ditulis seperti berikut :
A = nomor massa
X = lambang unsur
Z = nomor atom = jumlah proton = jumlah elektron
Jumlah neutron = A – Z
dengan :
A = 27
Z = 13
Jumlah neutron = 27 – 13 = 14.
Maka, dari soal diketahui bahwa isotop tersebut memiliki 13 proton, 13 elektron, dan 14 neutron.
Baca Juga : 60 Soal Termokimia Pilihan Ganda dan Pembahasan Simpel
16. Konfigurasi elektron dari unsur X adalah
![]()
Unsur tersebut terletak pada…
A. golongan IIIA periode 5
B. golongan VA periode 5
C. golongan VA periode 3
D. golongan IIIA periode 4
E. golongan VIA periode 5
Jawaban : B
Pembahasan :
menentukan letak unsur.
Unsur-unsur golongan utama memiliki elektron valensi yang terletak pada subkulit ns dan np dengan n menyatakan jumlah kulit dan periode sementara elektron valensi menyatakan letak golongan.
Dari subkulit 5s2dan 5p3 terlihat bahwa :
n = 5 → periode 5
eval = 2 + 3 = 5 → golongan VA
Jadi, unsur X terletak pada golongan VA periode 5.
Dengan cara lain :
![]()
Dari konfigurasi elektron yang diketahui, perhatikan ns, np, dan nd. Jumlahkan elektron yang ada pada n kulit yang sama. Sehingga secara sederhana konfigurasi elektron tersebut dapat kita tulis sebagai berikut :
X : 2 8 18 18 5.
Jadi, unsur X terletak pada golongan VA periode 5.
(Ujian nasional 2005/2006)
17. Di antara unsur-unsur
![]()
yang terletak pada golongan yang sama dalam sistem periodik unsur adalah…
A. P dan Q
B. P dan R
C. S dan T
D. Q dan S
E. R dan T
Jawaban : D
Pembahasan :
menentukan letak unsur
P : 2 8 2 → golongan IIA
Q : 2 8 6 → golongan VIA
R : 2 8 8 1 → golongan IA
S : 2 8 18 6 → golongan VIA
T : 2 8 18 18 7 → golongan VIIA
Jadi unsur yang terletak pada satu golongan adalah unsur Q dan S yaitu golongan VIA.
18. Nomor atom unsur X sama dengan 27. Jumlah elektron tidak berpasangan dalam ion X+2 adalah…
A. 1
B. 2
C. 3
D. 5
E. 7
Jawaban : C
Pembahasan :
Jumlah elektron tidak berpasangan

Diagram elektronnya berdasarkan aturan Hund :
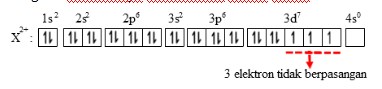
Jadi jumlah elektron yang tidak berpasangan pada ion tersebut adalah 3 elektron.
19. Lima unsur dalam satu periode dinyatakan sebagai berikut.
- (1) Massa atom unsur B lebih kecil daripada unsur C.
- (2) Keelektronegatifan unsur A lebih besar daripada unsur D tetapi lebih kecil daripada unsur B.
- (3) Energi ionisasi unsur E lebih kecil daripada unsur D.
- (4) Jumlah elektron valensi unsur A lebih kecil daripada unsur B.
Urutan letak unsur dalam tabel periodik unsur dari kiri ke kanan adalah …
a. A, B, C, D, dan E
b. A, B, C, E, dan D
c. C, E, D, A, dan B
d. E, D, C, B, dan A
e. E, D, A, B, dan C
Jawaban : E
Pembahasan:
- Massa atom unsur B lebih kecil daripada unsur C. Itu artinya, unsur B terletak di sebelah kiri unsur C.
- Keelektronegatifan unsur A lebih besar daripada unsur D tetapi lebih kecil daripada unsur B. Itu artinya, unsur A terletak di sebelah kanan unsur D dan di sebelah kiri unsur B.
- Energi ionisasi unsur E lebih kecil daripada unsur D. Itu artinya, unsur E terletak di sebelah kiri unsur D.
- Jumlah elektron valensi unsur A lebih kecil daripada unsur B. Itu artinya, unsur A terletak disebelah kiri unsur B.
Sehingga, urutan letak unsur dalam tabel periodik unsur dari kiri ke kanan adalah E, D, A, B, dan C.
20. Diketahui ion – ion dengan jumlah elektron sebagai berikut.
- (1) A2+, e = 2
- (2) B+, e = 36
- (3) C3-, e = 10
- (4) D–, e =10
- (5) E3-, e = 18
Unsur dari ion – ion yang memiliki sifat kimia sama ditunjukkan oleh angka …
A. 1 dan 2
B. 1 dan 4
C. 2 dan 3
D. 3 dan 5
E. 4 dan 5
Jawaban : D
Pembahasan:
Unsur – unsur yang memiliki sifat kimia sama merupakan unsur – unsur dengan jumlah elektron valensi yang sama. Itu artinya, kita harus mencari konfigurasi elektron unsur dari setiap ion – ion di atas.

